Przykładowy artykuł dotyczący wpływu zaburzeń rytmu dobowego na zdrowie człowieka w kontekście przyczyn przedwczesnych zgonów pielęgniarek w Polsce, m.in. wpływu pracy zmianowej na długość życia i zapadalności na różne choroby.
Zaburzenia rytmu dobowego a zdrowie człowieka – opublikowano 2021 r. /tłum. przed korektą/.
Zaburzenia rytmu dobowego są wszechobecne i mogą wystąpić na wielu poziomach organizacyjnych, przyczyniając się do złych wyników zdrowotnych na poziomie indywidualnym i demograficznym. Dowody wskazują na dwukierunkowy związek, ponieważ zaburzenia rytmu dobowego zwiększa nasilenie choroby, a wiele chorób może mieć wpływ na zaburzenia rytmu dobowego. Co ważne, zaburzenia rytmu dobowego mogą zwiększać ryzyko ekspresji i rozwoju zaburzeń neurologicznych, psychiatrycznych, kardiometabolicznych i immunologicznych. W związku z tym wykorzystanie bogatych odkryć z badań przedklinicznych i translacyjnych w biologii okołodobowej w celu poprawy zdrowia poprzez podejścia oparte na cyklu dobowym stanowi wyjątkową okazję dla medycyny spersonalizowanej / precyzyjnej i ogólnego samopoczucia społecznego. W tym przeglądzie omawiamy konsekwencje zaburzeń rytmu dobowego dla zdrowia ludzkiego za pomocą podejścia „od ławki do łóżka” (przyp. aut. od teorii do praktyki). Dowody z nauki przedklinicznej i translacyjnej są stosowane w podejściu klinicznym i populacyjnym. Biorąc pod uwagę szerokie implikacje zaburzeń rytmu dobowego dla zdrowia ludzkiego, niniejszy Przegląd koncentruje swoją dyskusję na wybranych przykładach w zaburzeniach neurologicznych, psychiatrycznych, metabolicznych, sercowo-naczyniowych, alergicznych i immunologicznych, które podkreślają współzależność między zaburzeniami rytmu dobowego a chorobą ludzką oraz potencjałem interwencji w cykl dobowy, takich jak terapia światłem i egzogenna melatonina, a także chronoterapia w celu poprawy i / lub modyfikowania wyników choroby.
Rytmy okołodobowe (circa, „około” i diem, „dzień”) to endogenne oscylacje z około 24-godzinnym cyklem. Rytmy okołodobowe w fizjologii i zachowaniu są zorganizowane przez centralny zegar „mistrzowski”, jądro suprachiasmatyczne (SCN) znajdujące się w przednim podwzgórzu, które współreguluje wyrównanie między zewnętrznymi środkami synchronizacji z zegarami okołodobowymi w innych regionach mózgu, a także w tkankach obwodowych. Rytmy okołodobowe są modulowane przez czynniki endogenne (genetyczne, fizjologiczne), a także środowiskowe (światowe) i behawioralne (aktywność, karmienie). W niniejszym przeglądzie używamy „zaburzenia okołodobowego” jako niespecyficznego terminu parasolowego do opisania zakłóceń, zaburzeń regulacji lub problemu, który negatywnie wpływa na funkcję okołodobową, ale jak zauważył Vetter, istnieje potrzeba jaśniejszej terminologii i ilościowego określenia zakłóceń okołodobowych 1(1). Staje się coraz bardziej jasne, że zakłócenia okołodobowe u ludzi mogą prowadzić do szerokich i znaczących konsekwencji dla zdrowia psychicznego i fizycznego (23, 3). Ponadto, zmian w funkcji okołodobowej często towarzyszą zaburzenia snu i czuwania, które również przyczyniają się do złych wyników zdrowotnych. Współzależność między rytmami okołodobowymi a ludzkimi chorobami może powodować błędne koło między ekspresją choroby a zakłóceniem okołodobowym, czego przykładem jest immunologia (4, 55), kardiometaboliczna 6(6), neurodegeneracja i zaburzenia psychiczne 7(7).
Ogólne mechanizmy zakłóceń w okołodobach
U ludzi pomiary zaburzeń okołodobowych obejmują fazę (timing), związek między rytmami wewnętrznymi lub wewnątrz-wewnętrznymi (dopasowanie), okres i amplitudę rytmów okołodobowych. Zakłócenia w fazie okołodobowej i amplitudy są najczęstszymi środkami, które były związane z niekorzystnymi konsekwencjami zdrowotnymi. Jak nakreślono w Rysunek 1 Zakłócenia okołodobowe mogą wystąpić na wielu poziomach, od zmian we krwi, komórkach, tkankach lub systemie do niewspółosiowania między różnymi poziomami organizacji i / lub cyklami behawioralnymi i środowiskowymi. „Molekularny zegar okołodobowy” odnosi się do genów, które utrzymują autoregulacyjne pętle sprzężenia zwrotnego, w których oscylacyjne wyniki regulują własną ekspresję (okołodobowe cykle wyjściowe ruchu motorycznego kaput [CLOCK (urząst)] mózg i mięśnie ARNT-podobne [BMAL] okres [PER (s)], podrodzina receptora nuklearnego / receptora nuklearnego 1, grupa D [NR1D (u)] i cryptochrome [CRY (u)]; ref.4).
Rys. 1 Schemat wzajemnych powiązań między zakłóceniami rytmu dobowego a chorobami człowieka. Jak pokazano w lewym górnym rogu, zakłócenia rytmu dobowego mogą wynikać z niedopasowania czynników zewnętrznych (takich jak naturalny cykl światło/ciemność, wymagania społeczne i zawodowe oraz zachowania, takie jak pora snu i posiłków) z głównym zegarem dobowym zlokalizowanym w jądrze nadskrzyżowaniowym (SCN), jak również z endogennymi zegarami dobowymi w innych tkankach. Typowe przykłady chronicznej niewspółosiowości zewnętrznej i wewnętrznej obejmują zmęczenie spowodowane zmianą strefy czasowej, pracę zmianową i nieprawidłowe ustawienie spowodowane nieodpowiednio dobraną w czasie ekspozycją na światło (wieczorem lub nocą). Zdjęcie w prawym górnym rogu przedstawia SCN i zegary peryferyjne w całym ciele. SCN integruje bodźce świetlne i niefotyczne, aby zsynchronizować czas innych zegarów mózgowych i biologicznych ze środowiskiem i zachowaniami. Zakłócenia na różnych poziomach organizacyjnych powodują zakłócenia w rytmie okołodobowym. Zakłócenia fazy i amplitudy rytmów dobowych mogą wystąpić na poziomie molekularnym, komórkowym i organizmowym. Na dole znajdują się przykłady wpływu zakłóceń rytmu dobowego i dwukierunkowości pomiędzy zakłóceniami rytmu dobowego a klasycznymi dobowymi zaburzeniami snu i czuwania oraz innymi przewlekłymi zaburzeniami medycznymi.
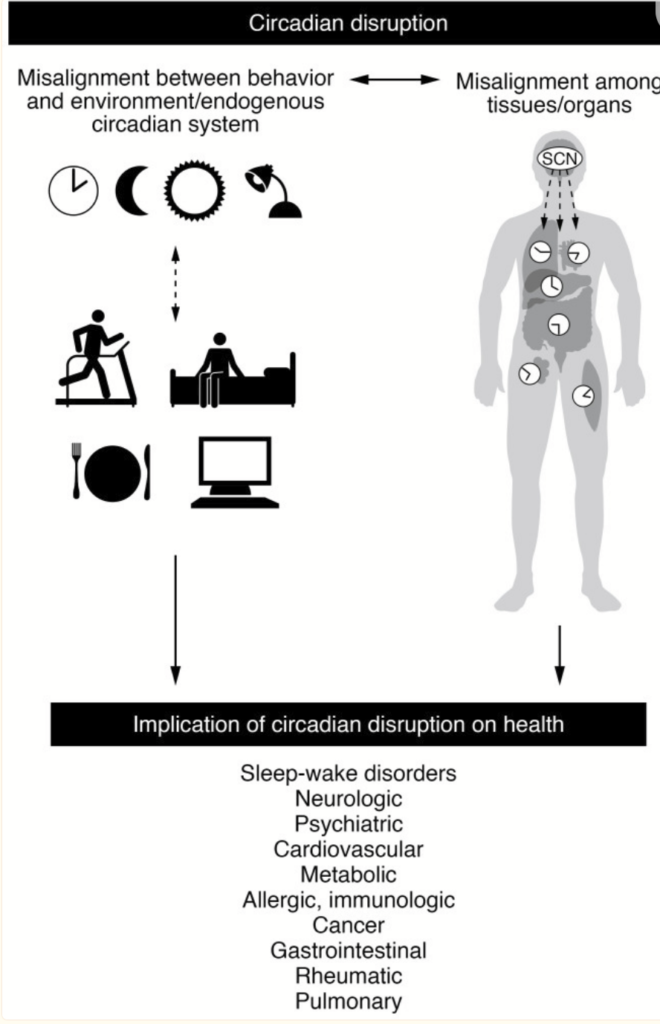
Schematyczny między zakłóceniami okołodobowymi a chorobami ludzkimi.
Jak przedstawiono wyżej na Rys.1 po lewej stronie , zakłócenia okołodobowe mogą wynikać z niewspółosiowości czynników zewnętrznych (takich jak naturalny cykl światło / ciemność, wymagania społeczne i pracownicze oraz zachowania takie jak czas snu i posiłków) z głównym zegarem okołodobowym znajdującym się w jądrze suprachiastycznym (SCN), a także z endogennymi zegarami okołodobowymi w innych tkankach. Typowe przykłady chronicznego niewspółosiowości zewnątrz-wewnątrz obejmują społeczne opóźnienie odrzutowe, pracę zmianową i niewspółosiowość z powodu nieodpowiedniej ekspozycji na światło czasowe (wieczorne lub noc). W prawym górnym rogu obraz przedstawia SCN i zegary obwodowe w całym ciele. SCN integruje lekkie i nieftyczne bodźce, aby zsynchronizować czas innych zegarów mózgu i ciała ze środowiskiem i zachowaniami. Zakłócenia na tych różnych poziomach organizacyjnych powodują zakłócenia okołodobowe. Zakłócenia w fazie i amplitudzie rytmów okołodobowych mogą wystąpić na poziomie molekularnym, komórkowym i organizmu. Na dole znajdują się przykłady wpływu zakłóceń okołodobowych i dwukierunkowości między zakłóceniem okołodobowym a klasycznymi okołodobowymi zaburzeniami snu i innych przewlekłych zaburzeń zdrowia.
Biomarkery rytmu okołodobowego i zakłócenia cyklu dobowego
Chociaż rytm SCN nie może być bezpośrednio mierzony u ludzi, czas wystąpienia i amplitudy zmierzonych w osoczu lub ślinie lub metabolit melatoniny 6-sulfatoksyfilatotoniny w moczu, są złotymi standardowymi biomarkerami rytmów okołodobowych. Zbieranie 24-godzinnych próbek moczu jest szczególnie przydatne do oceny amplikacji anatomii melatoniny okołodobowej w specjalnych populacjach, takich jak pacjenci pediatrzy, u których próbki krwi lub śliny mogą być trudne do uzyskania 8(8) i wykazano, że jest użytecznym biomarkerem reagowania na leczenie zaburzeń okołodobowych w chorobach neurologicznych, takich jak choroba Alzheimera (AD) 9(9) i epipsa pediatryczna 10(10). Chociaż mniej bezpośrednie, inne powszechnie stosowane środki obejmują cykle odpoczynku / aktywności pochodzące z aktygrafii i innych rytmów hormonalnych, metabolicznych i sercowo-naczyniowych 7(7).
Konsekwencje zaburzeń rytmu okołodobowego dla zdrowia publicznego
Konsekwencje zaburzeń z zakresu zdrowia publicznego w przypadku zakłóceń w cyklu okołodobowym są ogromne ze względu na liczbę osób dotkniętych chorobą i rosnące dowody na związek z zakłóceniami okołodobowymi z poważnymi niekorzystnymi skutkami zdrowotnymi. Populacja w Stanach Zjednoczonych jest zagrożona zakłóceniami okołodobowymi obejmują około 16% dorosłych, którzy zwykle pracują w niedzielnym harmonogramie 11(11), około 70% osób, które pracują w pomieszczeniach 12(12), szacunkowo 99% dotkniętych zanieczyszczeniem światłem (13) i rosnącym sektorem dorosłych w wieku 65 lat i starszych (14). Temat ten jest również ważny dla decyzji politycznych, które dotyczą ogółu społeczeństwa, takich jak debata publiczna i naukowa dotycząca czasu letniego i jego potencjalnego zagrożenia dla zdrowia i bezpieczeństwa (15). „Chronotyp” odnosi się do preferowanego czasu snu i aktywności, a wieczorne chronotypy („nocne sowy”) częściej doświadczają zakłóceń w cyklu okołodobowym z powodu rozbieżności między zegarem wewnętrznym a obowiązkami społecznymi lub zawodowymi i mają zwiększone ryzyko śmiertelności z jakiejkolwiek przyczyny w porównaniu z typami porannymi (16). Praca zmianowa zwiększa ryzyko złego stanu zdrowia psychicznego i fizycznego i jest uważana za „prawdopodobnie rakotwórcze” 7(7), a zatem ma wpływ zarówno na indywidualną politykę zdrowia, jak i zdrowia zawodowego.
Wiedza o cyklach okołodobowych należy do nauk podstawowych jest solidnie udowodniona, ale w mniejszym stopniu jest dostępna w obszarach zdrowia publicznego, klinicznego i jej wpływu na populację (17). Nadal istnieje znaczna luka w wyjaśnieniu jej wpływu, praktycznych aspektów na życie i zdrowie, zarówno jednostek, jak i populacji. Część tej luki wynika z braku wieloośrodkowych randomizowanych badań klinicznych i populacyjnych, które bezpośrednio koncentrują się na zaburzeniach okołodobowych, a także ograniczonej liczbie dobrze znanych przez pacjentów wyników i skalowalnych ludzkich biomarkerów zaburzeń okołodobowych. Ponadto badania ukierunkowane na kliniczny rytm dobowy wymagają podejścia opartego na wieku, ponieważ istnieją wyraźne różnice w fazie okołodobowej i amplitudzie, a także stabilności rytmów w całej długości życia.
W tym przeglądzie stosujemy oparte na dowodach podejście „bench-to-bedside”, stosujące badania w sprawie zakłóceń ryzyka okołodobowego i terapeutycznego dla niektórych z najbardziej rozpowszechnionych i palących chorób ludzkich. Stosujemy ten model, aby podkreślić wybrane przykłady wyników badań z pracy przedklinicznej i klinicznej, które są dojrzałe do tłumaczenia i wdrożenia w klinice, oraz opracowanie wytycznych dotyczących zdrowia publicznego. Wreszcie omawiamy strategie integracji czasu biologicznego w medycynie w celu optymalizacji i personalizacji opieki nad osobami z rytmem okołodobowym zaburzeń snu i czuwania, a także zakłócenia układu okołodobowego w kontekście choroby przewlekłej.
Poniższa dyskusja jest organizowana przez kluczowe obszary choroby zaburzeń okołodobowych w zdrowiu człowieka: neurologiczne, psychiatryczne, metaboliczne, sercowo-naczyniowe i alergiczne / alergiczne. Podkreślamy dowody epidemiologiczne i podstawowe potwierdzające związek między zaburzeniami okołodobowymi a zdrowiem ludzi, a następnie stosujemy model od ławki od łóżka, aby omówić przykłady docelowych mechanizmów w celu poprawy zdrowia okołodobowego w tych zaburzeniach.
Zaburzenia neurologiczne
Zakłócenia okołodobowe są powszechne w zaburzeniach neurologicznych, wpływające na rozwój, ekspresję i nasilenie choroby. Istnieje coraz więcej dowodów łączących zaburzenia okołodobowe z chorobą naczyń mózgowych, padaczką, migreną, stwardnieniem rozsianym, zaburzeniami neurodegeneracyjnymi i zaburzeniami neurorozwojowymi (7). Poza powiązaniem z ciężkością choroby, zaburzenia okołodobowe zwiększają ryzyko zaburzeń neurologicznych w ciągu całego życia (18).
Zaburzenia neurorozwojowe
Zakłócenia okołodobowe i zła jakość snu są powszechne w zaburzeniach neurorozwojowych, w tym w zaburzeniach ze spektrum autyzmu (ASD) i rzadkich genetycznych zaburzeń neurorozwojowych, takich jak Angelman, Williams, Prader-Willi, kruche zespoły X i Smith-Magenis. ASD są stosunkowo powszechne i są związane z kilkoma biomarkerami zaburzeń okołodobowych, w tym niewspółwyrównanym rytmem kortyzolu i rytmem melatoniny o niższej aplikacji (19). Wiodącą hipotezą jest to, że ASD indukuje dysfunkcję syntezy melatoniny (19). W rzeczywistości polimorfizmy jednonukleotydowe (SNP), takie jak receptory melatoniny MTNR1A i MTNR1B, mogą powodować ASD (20), a inne SNP genów zegara wydają się modulować związek między ciężkością ASD a nasileniem zaburzeń snu / zaburzeń okołodobowych (20). Zespół Smitha-Magenisa (SMS) jest spowodowany delecją w 17p1,2, która obejmuje gen kodujący kwas retinowy indukowany 1 (RAI1) (21). Niedobór myszy w RAI1 ma skrócony okres, który wydaje się być spowodowany aktywacją przez RAI1 transcription genu głównego (22). U ludzi RAI1 jest zamieszany w regulację wydzielania melatoniny (21). Dzieci z SMS wykazują odwrócenie endogennego rytmu melatoniny i cyklu snu / czuwania (23).
Jedna ze strategii tłumienia porannego poziomu melatoniny w SMS obejmuje podawanie antagonisty o 1 1r. adrrnergiczny (24). Suplementacja melatoniny jest również podstawową strategią dostosowania układu okołodobowego i poprawy snu i poznawczych mierników wyników (25). Suplementacja melatoniny do wyrównania (tj. Przesunięcie fazy) zwykle występuje w niższych dawkach 1 mg preparatów o natychmiastowym uwalnianiu podanych kilka godzin przed snem (26), podczas gdy dawki większe niż 1 mg wersji o przedłużonym uwalnianiu stosuje się do przedwarkiem snu (27). W ASD Malow i wsp. stwierdzili u dzieci z autyzmem, że leczenie melatoniną znacznie poprawiło jakość snu za pomocą doustnej melatoniny o przedłużonym uwalnianiu w dawkach 2 mg zwiększanej do 5 mg po 3 tygodniach i w razie potrzeby do 5-10 mg/d, jeśli jest to konieczne (28).
Zaburzenia neurodegeneracyjne
Coraz więcej dowodów wskazuje na dwukierunkowy związek między zaburzeniami okołodobowymi a neurodegeneracją, takimi jak traumatyczne uszkodzenie mózgu, (AD), choroba Parkinsona (PD) i choroba Huntingtona. Wykazano, że niewspółosiowanie i zmniejszona amplituda kilku rytmów przewidują rozwój chorób neurogeneracyjnych, takich jak AD i PD (29 – 31). W tej sekcji skupiamy się na najczęstszych chorobach neurodegeneracyjnych związanych z wiekiem, AD i PD.
W mysich modelach PD neurony SCN miały zmniejszoną aktywność, co może przyczynić się do zmniejszenia amplitudy i / lub niewspółosiowości rytmów okołodobowych (32). Dopamina odgrywa ważną rolę w regulacji centralnie generowanej rytmiczności okołodobowej poprzez bezpośredni wpływ na rytmy dobowe siatkówki (33), a także poprzez jej wpływ na fotoreceptory zawierające melanopsynę w siatkówce (34). W modelach naczelnych nieludzkim wyczerpywanie rytmiczności zaburzonej dopaminy, a to wydawało się być dodatkowo zaostrzone przez niewspółosiowość rytmów środowiskowych i behawioralnych (35). Zaburzenia okołodobowe u pacjentów z PD mogą wystąpić na każdym etapie choroby i mogą obejmować zmiany w fazie i amplitudzie odpoczynku / aktywności oraz rytmy melatoniny (36). Zakłócenie okołodobowe może wystąpić nawet przed wystąpieniem klinicznych objawów motorycznych, co sugeruje możliwą rolę w patogenezie choroby (37, 38).
Biorąc pod uwagę rytmywność okołodobową w farmakokinetyce lewodopy (39), prekursor dopaminy wskazany w leczeniu objawów PD, czas podawania może potencjalnie pomóc w optymalizacji skuteczności i zmniejszenia skutków ubocznych. Modele matematyczne są opracowywane w celu zintegrowania biomarkerów zaburzeń okołodobowych, takich jak ekspresja genu zegara i czas ekspozycji na światło, w celu przewidywania wpływu na neuroprzekaźniki, takich jak dopamina, oraz pomoc w leczeniu czasowym i wyborze celów leków (40). Testowane leki na bazie okołodobowej obejmują terapię jasnego światła, która poprawia nastrój (41), jakość snu i czujność w ciągu dnia (42). Co ciekawe, terapia światłem jasnym dwa razy na dobę przez 14 dni również zwiększyła obiektywny poziom aktywności fizycznej 42(42), a także poprawiła się sen i poprawiła kontrolę chorób (43). W PD melatonina była używana przede wszystkim ze swoich efektów soporcjowych (44).
Demencja i traumatyczne uszkodzenie mózgu (AD).
AD jest związany z zakłóceniem okołodobowym na wielu poziomach organizacyjnych, w tym utratą neuronów SCN 31(31) i upośledzeniem funkcji ścieżek wejściowych światła (degeneracja wewnętrznie światłoczułych komórek zwojowych retinowych; ref. 45). Ekologicznie zmniejsza się narażenie na działanie światła i ustrukturyzowanej aktywności. Te i inne czynniki mogą przyczyniać się do niskiej amplitudy i niedopasowania rytmów okołodobowych na wielu poziomach organizacji (7, 31, 46 – 53), które z kolei wykazano, że korelują ze stopniem zaburzeń neurologicznych (54, 55). U myszy niewspółosiowaść między rytmami karmienia a SCN powoduje upośledzenie pamięci (56), co poprawia się w przypadku harmonogramów karmienia (57). Ponadto istnieją dowody na niewspółosiowe traktowanie aktywności neuronalnej w różnych regionach mózgu, takich jak między SCN i hipokampem (58, 59). Dowody na to, że zakłócenie okołodobowe zwiększa ryzyko pogorszenia funkcji poznawczych, a AD (30) zwiększa prawdopodobieństwo, że poprawa funkcji okołodobowych może spowolnić upośledzenie funkcji poznawczych związanych z wiekiem.
Terapia światłem, szczególnie poranne światło bogacące w niebieskie, może być skuteczna w poprawie jakości snu i funkcji poznawczych (60), a dowody wskazują, że terapia światłem zmniejsza zapalenie nerwów i stres oksydacyjny w celu poprawy snu i poznania (61). Rzeczywiście, te terapie oparte na około dobyciu, w tym modyfikacje zachowań snu (62), stają się coraz bardziej częścią standardowej opieki nad AD i mogą zwalczać pogorszenie funkcji poznawczych (30). Zwiększenie ekspozycji na światło dzienne może poprawić rytmiczność i pomóc w konsolidacji snu (63). W przeglądzie systemowym i metaanalizie suplementacja melatoniny wydawała się znacznie poprawiać wyniki w badaniu Mini-Mental State Examination w dziewięciu badaniach łagodnej AD (64). Jednak dowody są słabe, a niedawny przegląd Cochrane wykazał, że melatonina, nawet przy wyższych dawkach, nie poprawiła środków snu w porównaniu z placebo (65).
Zaburzenia psychiczne
Zakłócenia okołodobowe są powszechne w chorobach psychicznych, w tym ze schizofrenią i zaburzeniami nastroju, takimi jak depresja, choroba afektywna dwubiegunowa i sezonowe zaburzenia afektywne (21, 66, 67). W tej sekcji skupiamy się na zaburzeniach nastroju jako powszechnych przykładach roli zaburzeń okołodobowych w rozwoju zaburzeń psychicznych i potencjału terapii psychiatrycznej pochodzenia okołodobowego. Inne opublikowane recenzje w tej dziedzinie (21, 66, 67) zagłębiają się w zaburzenia psychiczne, które są poza zakresem niniejszego Przeglądu, w tym zaburzenia związane z używaniem substancji (21).
Zaburzenia nastroju
Związek między zaburzeniami okołodobowymi a zaburzeniami nastroju jest dobrze ustalony (68-70). Sezonowe zaburzenie afektywne charakteryzuje się wystąpieniem lub pogorszeniem depresji w miesiącach jesiennych i zimowych, gdy dzienny czas trwania światła dziennego zmniejsza się (66), a pacjenci są objawowi w wyniku sezonowo indukowanego niewspółmiernego dobowego niewspółmiernego zmieszaniami okołodobowym. Dokładna ocena fazy okołodobowej i fazy zmiany leczenia może poprawić objawy depresyjne (68). Innym przykładem jest opóźnione zaburzenie fazy czuwania za sennego (DSWPD), w których niewspółosiowość między początkiem melatoniny a snem powodowała zwiększone prawdopodobieństwo wystąpienia objawów depresyjnych (OR x 4,31, 95% CI 1,75-10,64) i zaostrzenie DSWPD (71). „Depresja okołodobowa” jest niedawno używanym terminem do opisania tego potencjalnego fenotypu klinicznego, który wymaga ukierunkowanego na dobytku leczenia określonych zaburzeń nastroju, o czym świadczy specyficzna rytmika / sezonowość do objawów, przebiegu klinicznego, obiektywnych parametrów okołodobowych i odpowiedzi leczenia (72).
Dowody przedkliniczne dodatkowo pokazują dwukierunkowy związek między zaburzeniami nastroju a układem okołodobowym u myszy, w którym manipulacja receptorami serotoninowymi powodowała same indukowanie zaburzeń okołodobowych (73). Zewnętrzne czynniki okołodobowe, takie jak światło w niewłaściwym czasie w modelu myszy, wywołują również oznaki depresji (74), pośredniczone przez niewłaściwie wrażliwe komórki zwojów siatkówki i ich projekcji do obszarów podwzgórzowych, preotycznych i limbicznych, takich jak ciałagłowa (75). U ludzi funkcjonalne badania MRI wykazały, że światło hamuje aktywność ciała migdałowatego, ale poprawia łączność w korze przedczołowej (76), co sugeruje potencjalne mechanistyczne wyjaśnienie wpływu światła na nastrój. Inne mechanistyczne czynniki chorobowe w przypadku zaburzeń nastroju u ludzi obejmują zmianę ekspresji genów zegara (77) i polimorfizmy genetyczne w genach zegarowych (np. PER3 rs57875989 jest związany z lękiem; ref. 79). Jako osobny punkt synchronizacja czasu zegara mózgowego ze środowiskiem zewnętrznym może zmniejszyć depresję (80). Niedawne badanie tysięcy pacjentów w kilku dużych kohortach wykazało, że wcześniejsze punkty środkowe snu wiązały się z 23% niższym ryzykiem depresji (80).
Okołodobowe podejście do terapii psychiatrycznej
Opisane powyżej wyniki potwierdzają potencjał metod leczenia okołodobowego w leczeniu chorób psychicznych. W rzeczywistości leki psychiatryczne, takie jak selektywne inhibitory wychwytu zwrotnego serotoniny, mają działanie różnicowe w różnych warunkach świetlnych u ludzi (81). Chronotyp wpływa również na skuteczność terapeutyczną. Na przykład pacjenci z chorobą afektywną dwubiegunową, którzy reagują na lit, wydają się być „porannymi skowronkami” (82), a lit może wzmocnić amplitudę okołodobową u tych, którzy są odpowiadającymi na leczeniem (83, 84). Co ciekawe, zaburzenia okołodobowe wywołane litem w niektórych osobach nieodpowiadających mogą zostać pokonane przez przyciągnięcie dozby do dołu z czynnikami synchronizującymi lub zeitgeberami (83). Zastosowanie jasnej terapii światłem ma znaczenie dla wielu zaburzeń nastroju, takich jak poważna depresja (85), choroba afektywna dwubiegunowa (86 – 88) i sezonowe zaburzenia afektywne (89, 90). Ważne jest, aby pamiętać, że skuteczność terapii światłem jasnym w badaniach klinicznych zaburzeń nastroju jest zmienna i zależy od rodzaju użytego światła, czasu stosowania i przestrzegania przez pacjentów (91). Warto wspomnieć o rozwijającej się literaturze dotyczącej zespołu nadpobudliwości psychoruchowej z deficytem uwagi (ADHD), która sugeruje, że faza postępu przez jasne światło może skorygować zakłócenia w dobydzieniu bez powodowania zmian w śnie i poprawia objawy ADHD (92), które mogą być również osiągnięte przez etap postępu za pomocą melatoniny (93).
Zaburzenia metaboliczne
Intymna zależność między systemem okołodobowym a metabolizmem ma kluczowe znaczenie dla optymalizacji ekstrakcji energii i wykorzystania energii z żywności w okresie aktywnym i przetwarzania zmagazynowanej energii podczas fazy odpoczynku w celu utrzymania stabilnego poziomu glukozy podczas nocnego postu. Wpływ zakłóceń okołodobowych na zaburzenia metaboliczne był obszarem intensywnych badań. Kilka wysokoaktywnych recenzji (94 – 97) podsumowuje zbliżenie regulacji i metabolizmu okołodobowego. W tym przeglądzie skupiamy się na pętli negatywnego zwrotu o zwroty między zakłóceniami okołodobowymi, cukrzycą i otyłością.
Metabolizm i cukrzyca
Istnieje dobrze ustalone, że dysregulacja okołodobrożna wpływa na metabolizm na poziomie genetycznym, komórkowym i systemowym, powodując upośledzoną tolerancję glukozy i insulinooporność oraz zwiększone ryzyko zespołu metabolicznego i cukrzycy (98). Zakłócenie genu zegara rdzeniowego, takie jak u zmutowanych myszy z mutacji , pokazuje głęboki wpływ mutacji genu zegara na metabolizm, wraz z rozwojem otyłości i zespołu metabolicznego (99). Utrata Bmal1 zwiększa wrażliwość na insulinę (95), a także specyficzne dla tkanek mechanizmy niewspółosiowego (100). W rzeczywistości społeczne jet lag (przesunięcie czasu snu między pracą a wolnymi dniami) również wiązało się z zespołem metabolicznym i zwiększonym hemoglobiną glikozylowaną (101). Niedostosowanie u osób z późniejszym chronotypem może wyjaśnić, dlaczego są bardziej narażone na nadwagę i cukrzycę typu 2 (102, 103103). Nawet wśród pacjentów z cukrzycą typu 2, osoby, które są typami wieczora, mają gorszą kontrolę glicyjną (104 – 106106). Badania te sugerują, że rozbieżności między czasem wewnętrznym a czasem społecznym mogą prowadzić do zaburzeń metabolicznych.
Czas spożywania żywności wpływa również bezpośrednio na poziom glukozy we krwi. Na przykład zjedzenie tego samego posiłku przy śniadaniu, obiedzie lub kolacji spowoduje najniższy skok glukozy na śniadanie, podwojony podczas kolacji (94). W rzeczywistości ciągła infuzja glukozy wykazała, że poziom glukozy we krwi jest najwyższy w nocy, gdy organizm nie spodziewa się otrzymać glukozy. Eksperymentalne badania na ludziach, które indukowały zaburzenia okołodobowe, zrekapitulowały podwyższony poziom glukozy, pomimo kontrolowanego spożycia pokarmu i zwiększenia poziomu insuliny (6, 107). Niewspółosiowość cyrcadyjska zmniejsza również tolerancję glukozy i upośledza wrażliwość na insulinę (108 – 110), zapewniając potencjalny mechanizm wyjaśniający zwiększone ryzyko cukrzycy u pracowników zmianowych. Inną populacją zagrożona niewspółosiowość okołodobową są kobiety w ciąży, a większe ryzyko cukrzycy ciążowej zaobserwowano u osób z późniejszymi zaburzeniami środkowymi spa 111(111).
Czas, intensywność i długość fali ekspozycji na światło mogą również modulować funkcje metaboliczne, a wieczorne światło wzbogacone niebieskim ma najsilniejszy negatywny wpływ poprzez zwiększenie poziomu glukozy we krwi (112). Rzeczywiście, kilka badań wykazało, że zaburzenia 114ściemne światła w ciągu dnia i (lub) nadmiernego światła wieczornego zakłócają zegary metaboliczne, takie jak u pacjentów z cukrzycą, u których poziom cukru we krwi jest trudniejszy do kontrolowania (113, 114). Zwiększona ekspozycja na światło dzienne i promocja światła cękcia wieczorem w celu poprawy wyrównania okołodobowego to jedna ze strategii, która może poprawić metabolizm i kontrolę chorób kardiomomocbolicznych 114(114). Ponadto ostatnie dowody z badań przedklinicznych i klinicznych wskazują, że ograniczone czasowo karmienie i czasowe narażenie na światło mogą być ważnymi strategiami w celu dostosowania czasu przyjmowania energii do rytmów metabolicznych regulowanych przez zegar. Takie podejścia oparte na dobytku mają potencjał poprawy zdrowia metabolicznego, a może nawet regulacji wagi (115 – 117117).
Otyłość
Biorąc pod uwagę silny związek otyłości z mutacją zegara 19 u myszy, nie jest zaskakujące, że warianty genów CLOCK, takie jak rs6820823, rs3792603, rs11726609 118(118) i rs1801260 (119), są związane z podwyższonym BMI u ludzi. Można zidentyfikować polimorfizmy CLOCK, takie jak rs3749474, aby skuteczniej spersonalizować leczenie odchudzania, na przykład z ograniczeniem spożycia tłuszczu w diecie (120). Polimorfizmy w genach kodujących receptory melatoniny są również związane z dysfunkcją metaboliczną i otyłością (121 – 125), a związek między nocnym spożyciem pokarmu a otyłością może częściowo pośrednie w wyniku tych polimorfizmów receptora melatoniny 126(126). Potencjalne mechanizmy łączące akrodowe zakłócenia w przybieraniu na wadze i otyłości u pracowników zmian nocnych obejmują zmniejszenie dziennego wydatku na energię po nocnych zmianach 127(127), spotęgowanych przez rozregulowanie hormonalnej (leptyna / grelina) sygnalizujące jedzenie 128(128).
Pracownicy zmianowi są populacją ryzyka zaburzeń metabolicznych, cukrzycy typu 2 i otyłości (129 – 131). W systematycznym przeglądzie pracy zmianowej i zespołu metabolicznego istniał związek między zespołem metabolicznym a pracą zmianową (OR 1,29, 95% CI 1,06–1,52) 132(132). Social jet lag jest związany z nadwagą, a im większa rozbieżność w okresie snu, tym większa częstość występowania (101, 133133).
Jako metoda poprawy wyrównania okołodobowego, szczególnie między centralnymi i obwodowymi tkankami metabolicznymi, czasowo karmieniem zwierząt, nawet zwierzętami na diecie wysokotłuszczowej, poprawiła funkcję okołodobową 134(134). Karmienie ograniczone czasowo jest również proponowaną strategią zapobiegania chorobom metabolicznym (135, 136136). Ostatnie badanie sugeruje korelację między wrażliwością na insulinę a proporcją kalorii spożywanych rano 137(137), co należy rozważyć w odniesieniu do rytmu melatoniny 138(138). Podejmując krok dalej, systematyczny przegląd karmienia ograniczonym czasowo u ludzi w siedmiu badaniach wykazał, że spowodowało to średnią utratę masy ciała o 2,88 kg (95% CI x 3,96 do -1,80) (139), chociaż wpływ na utratę wagi jest w dużym stopniu zależny od specyficznego protokołu interwencyjnego 135(135).
Zaburzenia sercowo-naczyniowe
W artykule z 1985 roku w New England Journal of Medicine opisano czas zawałów mięśnia sercowego (MIs; powszechnie znane jako zawały serca), z większym prawdopodobieństwem zdarzeń występujących między 6 rano a południem (140). W dalszych badaniach zidentyfikowano podobny czas tego ryzyka udaru 141(141) i arytmii komorowych 142(142). Ten wrażliwy poranek nie jest wyjaśniony samymi spustami behawioralnymi, tj. karmieniem, snem itp. (143 – 145). Wydaje się raczej, że częściowo wynika to z okołodobowej regulacji czynników protrobskrzepowych, takich jak płytki krwi i progomorowy inhibitora aktywatora plazminogenu-1 (PAI-1) (146, 147147). Ponieważ układ okołodobowy reguluje czas pracy układu sercowo-naczyniowego (CV), gdy występuje zakłócenie okołodobowe, istnieje głęboki wpływ na zdrowie CV.
Ostre zdarzenia sercowe, a ryzyko CV
Wykazano, że niewspółosiowalność między rytmami środowiskowymi lub behawioralnymi a zegarami centralnymi lub obwodowymi zwiększa ryzyko chorób sercowo-naczyniowych (CVD). Modele zwierzęce wykazują, że arytmia i zdarzenia 6sercowo-naczyniowe objawiają się w warunkach niewspółosiowego okołodobowego (niezrównanie okołodobroż) (6).
Zawał mięśnia sercowego i udar mózgu.
U ludzi niewspółosiowość okołodobowa może wywoływać nadciśnienie i stan zapalny (z czego przykład chorują na biomarkery, takie jak białko C-reaktywne) 148(148), co częściowo może wyjaśniać dane epidemiologiczne łączące pracę zmianową z MI i udarem mózgu (149). W myjskich modelach udaru jedna konsekwencją funkcjonalną dłuższego czasu trwania „pracy przesunięcia” jest podwyższone wskaźniki zapalne i ostatecznie gorsze nasilenie udaru (150). Modulacja i interakcja między zaburzeniem sercowo-naczyniowym i aoktyniem okołodobowym są przykładem odkrycia, że u pacjentów z cukrzycą typu 2 CLOCK rs4580704 SNP wiąże się ze zwiększonym ryzykiem udaru 151(151). Dowody wskazują, że uszkodzenie CV i ryzyko wystąpienia zdarzeń sercowo-naczyniowych u pracowników zmianowych w nocy wynikają z zakłócenia cyrkudowego wywołanego przez IL-6 mechanizmu zapalnego 152(152), o czym świadczy zwiększona grubość wiązki szyjnej 153(153). Inne rodzaje zaburzeń okołodob-dobowych, w tym opóźnienie społeczne lub późne chronotyp, zwiększają czynniki ryzyka sercowo-naczynia, takie jak zwiększona częstość akcji spoczynkowych i nadciśnienie (103, 154 155155) i są związane ze zwiększoną częstością występowania chorób sercowo-naczyniowych (16).
Nadciśnienie.
Okołodobowa regulacja ciśnienia krwi występuje w stanie niezakłóconym przez zwiększony nocny parasympatyczny (156) tonu, który zapewnia kardioprotekcyjne nocne zaburzenie ciśnienia krwi (157-159). Niedostosowanie się, takie jak w jednym małym badaniu społecznego jet lag, może zmienić ton przywspółczulny podczas snu (160). Przegląd badań na pracownikach zmianowych potwierdza, że to zakłócenie okołodobowe powoduje wzrost sympatycznego tonu i obniżki kardioprotekcyjnego tonu (161). Rzeczywiście, eksperymentalne wywołanie zaburzeń rytmu dobowego u ludzi zwiększa ciśnienie krwi (6, 108, 149).
Arytmia
W odniesieniu do arytmii, 44% transkrypty nosa zatokowego ma zmienność niedokrwienna (162). W jednym z badań na myszach, nienaturalnie ograniczająca karmienie do pozostałego okresu odpoczynku zdemaskowanego zespołu długiego QT (163). Dodatkowo, myszy mieszkające w niedługim cyklach światło/ciemno, nawet w stabilnych warunkach pracy (podobne do zmiany warunków pracy) indukowały niewspółosiowość fazową między środowiskiem a wewnętrznym czasem okołodobowym, a ta faza niewspółosiowa była czynnikiem funkcjonującym nieprawidłowości serca, w tym przedłużony odstęp QT (164).
Strategie terapeutyczne oparte na cyklu okołodobowym dla CVD.
Strategie mające na celu zwiększenie amplitudy i stabilnego wyrównania są potencjalnie korzystne. Biorąc pod uwagę wrażliwe okno czasowe zdarzeń sercowo-naczyniowych i hipotetyczne ogniwo okołodobowe, badania myszy wykazały, że ekspresja głównego genu zegara Per2 wydaje się chronić przed uszkodzeniem mięśnia sercowego i reperfuzyjnym (165 – 167). Centralna i obwodowa ekspresja PER2 może być indukowana przez świetlną aktywację receptorów melanopizyny w komórkach zwojeniowych siatkówki (165, 168, 169), a terapia jasna w celu zwiększenia amplitudy PER2 może chronić przed uszkodzeniem niedokrwiennym (167 170) i zmniejszyć agregację płytek krwi 171(171).
U ludzi terapia światłem jasna rano może rzeczywiście indukować ekspresję PER2 w próbkach połykawnych lub osocza (170). To odkrycie, a także mechanistyczne badania na zwierzętach doprowadziły do badania dowodu koncepcji u ludzi przy użyciu jasnej terapii światłem (10 000 luksów od 8:30 do 9:00 rano każdego ranka przez 5 dni) w celu oceny ścieżek ryzyka sercowo-naczynienia. Naukowcy odkryli, że mogą celować w wrażliwe poranne okno czasowe na zdarzenia sercowo-naczyniowe, skracając czas krzepnięcia i zmniejszając kilka szlaków prokoagulacyjnych mierzonych na proteomiki próbek krwi, w tym inhibitorów tkanek metaloproteinazy (TIMP-1), PDGFA / B i czynnika płytek krwi 4 (PF4) (171).
Ponadto, manipulowanie czasem terapii lub chronoterapii dla CVD przyciąga uwagę. Próby terapeutyczne w walce z nadciśnieniem poprzez leczenie oparte na czasie zyskały znaczną uwagę; nawet nocne ćwiczenia zostały przetestowane jako możliwa strategia 172(172). Niedawno opublikowane badanie z dużą próbką pacjentów z nadciśnieniem tętniczym przez około 6 lat wykazało, że leczenie przed snem zmniejszyło ryzyko wszystkich mierzonych zdarzeń sercowo-naczyniowych (udar, MI, niewydolność serca) 173(173). Chociaż pojawiły się pewne kontrowersje dotyczące projektu badania 174(174), systematyczny przegląd dziesięciu opublikowanych badań wspierał również wieczorne dawkowanie ciśnień krwi 175(175). Należy jednak rozważyć, że farmakokinetyka różni się między lekami przeciwnadciśnieniowymi, a przełożenie tych wyników na praktykę kliniczną powinno uwzględniać okres półtrwania i czas do działania szczytowego. 176Potrzebne są dalsze prospektywne badania, które oceniają korzyści płynące z wieczornego dawkowania dla określonych populacji (176). W stanach chorobowych, takich jak obturacyjny bezdech senny, poranne dawkowanie może być nadal preferowane 177(177).
Zaburzenia immunologiiczne
Okołodobowa kontrola układu odpornościowego jest obszarem ważnym badaniu, które pokazuje subtelny związek między układem okołodobowym, układem odpornościowym i snem (193 – 202). Wynika z tego, że zaburzenia okołodobowe są związane z zaburzeniami odpornościowymi 203(203). W tym przeglądzie podkreślamy związek między zakłóceniami okołodobowymi, astmą 204(204) i innymi chorobami alergicznymi 205(205).
COVID-19
Pandemia COVID-19 stanowi przykład wzajemnych relacji między zdrowiem człowieka a zakłóceniami w immunologii cyklu okołodobowego. W szczególności niewspółosiowość okołodobowa, taka jak praca zmianowa, może zwiększać ryzyko zakażenia SARS-CoV-2 (206 – 208). Chociaż nie ma danych specyficznych dla COVID-19, pora dnia zakażenia patogenami wydaje się zmieniać podatność (209, 210). Po zakażeniu SARS-CoV-2 ciężka choroba (podobnie jak inne ciężkie choroby) wydaje się powodować zakłócenia okołodobowe, poprzez zacieranie normalnych rytmów odpoczynku / aktywności (211). Spekuluje się, że aktywne zakażenie SARS-CoV-2 może również tłumić rytm melatoniny i zmienić czas ekspresji genów zegara, powodując nieprawidłowy wyrównanie i regulację szkodliwej ekspresji zapalnej cytokin (212). Jeśli chodzi o terapię, system okołodobowy może potencjalnie poprawić wyniki choroby COVID-19 (212 – 214214). Na przykład poranne podawanie leczenia przeciwwirusowego (darunawir/rytonawir) może być bardziej skuteczne w zmniejszaniu stanu zapalnego, mierzonego biomarkerem białkiem C-reaktywne (215).
Astma
W zmutowanych myszach zegara – lub Bmal1, niewspółosiowość między genami zegara a narządami powoduje wady bariery nabłonkowej skóry (216), jelita (217) i dróg oddechowych (218). Ponadto usunięcie dalszego celu Bmal1, Rev-Erba powoduje, że gen zegara i niewspółosiowość komórek, prowadząc do zmniejszenia odpowiedzi przeciwwirusowej i zwiększonej reakcji na responsywność alergenu, przełożenie na fenotyp podobny do astmy (219, 220). Wydaje się, że niewspółosiowość między rytmami środowiska a SCN również zwiększa ryzyko astmy u pracowników zmianowych (OR 1,23, 95% CI – 1,13-1,46] (21). Mechanizm stojący za zwiększonym ryzykiem astmy u pracowników zmianowych może być również podatnością genetyczną na zakłócenia okołodobowe. Na przykład istnieje związek wariantów genów zegara, takich jak TIMELESS, z astmą u dzieci (222), a wyższe szanse na astmę są zauważane u pracowników zmianowych z porannym, którzy musieli pracować w nocy (221). Argumentuje to za rozważenie chronotypu okołodobowego w projektowaniu spersonalizowanych harmonogramów pracy zmianowych w celu poprawy zdrowia. Co ważne, niedotlenienie w astmie lub w innych warunkach jest jednym czynnikiem wywołanym chorobą, który wydaje się nadal promować niewspółosiowość okołodobową z powodu specyficznych dla tkanek, zależnych od czasu zmian transkrypcyjnych (223).
Chociaż istnieją ograniczone dane, czas można wykorzystać do personalizacji terapii astmy, poprzez chronoterapia (Rysunek 2). Na przykład wkładka opakowania do montelukast, antagonistyczna antagonistyczna receptora leukotrien, sugeruje, że wieczorne podawanie może poprawić skuteczność (224). Zwrócenie uwagi na czas może nawet dostosować ryzyko skutków ubocznych terapii. Bavishi i in. opisali zwiększoną częstość reakcji skórnych na zastrzyki alergiczne (podskórna immunoterapia alergenna) po południu w porównaniu z porannym (225).

Podejście multimodalne w celu rozwiązania problemu zakłóceń w doborach i jego wpływu na zdrowie.
Podejścia diagnostyczne, w tym obecne narzędzia, opierają się przede wszystkim na samodzielnych i behawioralnych środkach i wymagają wielokrotnego pobierania próbek biomarkerów, aby uzyskać 24-godzinny profil. Jednak narzędzia w fazie rozwoju mają na celu ocenę fazy okołodobowej za pomocą jednej próbki czasu wielu rytmów. Terapie pochodzenia środkowego, takie jak czasowa ekspozycja na jasne światło i egzogenna melatonina, są powszechnie stosowane w celu dostosowania fazy zewnętrznych / behawioralnych rytmów z endogennymi zegarami centralnymi i obwodowymi. Ponadto ograniczone czasowo karmienie może poprawić wyrównanie zegarów obwodowych i poprawić zdrowie metaboliczne. W fazie rozwoju znajdują się multimodalne podejścia do docelowych zegarów centralnych i obwodowych z dynamicznym oświetleniem okołodobowym, ograniczonym czasowo karmieniem i lekami w celu wyrównania i ustabilizowania chronophamaterapii, aby zoptymalizować skuteczność i tolerancję leków. CRSWD, dobowy rytm snu zaburzeń snu.
Inne choroby alergiczne
Tutaj opisujemy inne powszechne choroby alergiczne, takie jak anafilaksja (226), atopowe zapalenie skóry 4(4) i alergiczny nieżyt nosa (227). W mysim modelu pasywnej anafilaksji skórnej (226) wiele mechanizmów zakłócenia okołodobowego obniżyło próg reakcji alergicznych i zmieniło rytmiczny wzór reakcji; obejmowały mutacje Per2Per2, specyficzną mutację zegara limfocytów tucznych i ograniczone czasowo (w okresie odpoczynku) u myszy (228 – 230). Potwierdza to hipotezę, że zakłócenie okołodobowe spowodowane wieloma mechanizmami może zwiększać ryzyko ciężkiej reakcji alergicznej.
Ze względu na nocną dominację choroby alergicznej 4(4), stopień zaburzeń nocnych definiuje poziom ciężkości choroby w przypadku astmy i alergicznego nieżytu nosa i bezpośrednio wpływa na decyzje dotyczące leczenia przez lekarzy 231(231-323). Ukierunkowanie na choroby alergiczne powinno obejmować ocenę czasu objawów, takich jak zaostrzenie astmy, klasycznie około 4 rano (czas pracy płuc i zwiększona liczba limfocytów w płucach) (234, 235235). Objawy alergicznego zapalenia błony nieżytowej nosa osiągają szczyt między 4 a 6 rano, w czasie, gdy liczba pyłków jest wysoka; pacjent jest poziomy (sleeing); i kiedy rytmy zapalne są wzrosną w górę – z których wszystkie mogą zwiększyć obrzęk górnych dróg oddechowych (227). Objawy zapalenia skóry (wypryska) również wydają się osiągać szczyt wieczorem, a nocne drapieżne osiąga szczyt około 3 godziny po ścieżu (236).
Przedkliniczne testy na ludziach również zebrały dowody potwierdzające strategię terapeutyczną „przeciągania zegara”, na przykład poprzez selektywny inhibitor kinazy kazeinowej. W komórkach tucznych ma to podobne działanie do kortykosteroidu, tj. występuje supresja reakcji alergicznych za pośrednictwem IgE w komórkach tucznych myszy i zmniejszenie reaktywności basofilów u ludzkich bazofilów pacjentów z alergicznym zapaleniem błony alergicznej (237). Sugeruje to ekscytującą rolę terapeutów okołodobowych w zwalczaniu chorób alergicznych i immunologicznych. W mysim modelu zwłóknienia płuc, odurzenie genu zegara przez hamowanie Rev-Erba może hamować aktywację miofiroli i potencjalnie zapobiegać zwłóknieniu (238).
Wnioski:
Badania „od ławy do łóżka” tj. od teorii do praktyki określonej grupy populacji podkreślają wielkość i wzajemne ze sobą powiązania pomiędzy zaburzeniem rytmu dobowego w powstałych chorobach mających związek z cyklem okołodobowym oraz w praktyce wpływu cyklu okołodobowego do zapobiegania i optymalizacji zdrowia indywidualnego i społecznego. Oprócz specyficznych dla choroby skutków zaburzeń okołodobowych, efekty transdiagnostyczne są zauważane w wyniku określonych koneksji snu / okołodobowe (np. późny / wieczorny chronotyp, społeczny „jet lag”). Biorąc to pod uwagę, niekorzystne wyniki zdrowotne są mało prawdopodobne, aby wystąpiły w izolacji, a strategie terapeutyczne, takie jak suplementacja melatoniny lub terapia światłem, mogą być zharmonizowane w leczeniu wielu schorzeń. Jednak niewiele badań klinicznych przeprowadzono z jedynie słabymi zaleceniami dotyczącymi leczenia zaburzeń okołodobowych.
Odkrycie genetycznych podstaw rytmu dobowego, wraz z odkryciami, że ta maszyna genetyczna zegara istnieje w praktycznie wszystkich komórkach i tkankach oraz reguluje procesy metaboliczne, odpornościowe i neuronowe i szlaki, zasadniczo zmieniło nasze spojrzenie na znaczenie zdrowia okołodobowego w medycynie. Medycyna okołodobowa jest stosunkowo nową koncepcją, ale szybko nabiera rozpędu na całym świecie. Równolegle z badaniami translacyjnym istnieje wyraźna potrzeba identyfikacji biomarkerów, które są istotne klinicznie, ale także skalowalne na poziomie populacji. Szybki rozwój technologii do urządzeń do noszenia i czujników środowiskowych, w połączeniu ze sztuczną inteligencją, pozwoli nam ocenić czas okołodobowy wielu rytmów na różnych poziomach organizacyjnych w czasie rzeczywistym, aby uzyskać wgląd w interakcje między środowiskiem, zachowaniem oraz zegarami centralnymi i obwodowymi w zdrowiu i chorobie. Wreszcie, potrzebne są badania kliniczne i zwężenie luki „od ławki od łóżka”. Na przykład, chociaż około 1000 genów jest zaangażowanych jako cele leków lub w metabolizmie leków / transport (239), tylko kilka z najczęściej przepisywanych terapii w medycynie ma wskazania do podawania (240). Nie dzieje się tak dlatego, że terapie nie działają lepiej z podaniem czasu, ale raczej dlatego, że w badaniach klinicznych brakuje określenia optymalnego czasu. Mamy dobry plan, jak zintegrować czas okołodobowy w medycynie, a teraz jest czas, aby przyspieszyć badania specyficzne dla choroby.
Podziękowanie
Autorzy przyjmują do wiadomości finansowanie w następujący sposób: ABF otrzymało dofinansowanie od NIH (grant 5K23AR075108); PCZ otrzymało dofinansowanie z NIH (gł. R01-HL140580, P01-AG01011412; R01-AG059291, T32-HL007909); KLK otrzymał dofinansowanie z NIH (gł. R01-AG091411, P01-AG01-010111,41)
Prawa autorskie: 2021, Amerykańskie Towarzystwo Badań Klinicznych.
Informacje referencyjne: J. Clin Invest. 2021;131(19):e148286.https://doi.org/10.1172/JCI148286.
Bibliografia:
1. Vetter C. Circadian disruption: what do we actually mean? Eur J Neurosci. 2020;51(1):531–550. doi: 10.1111/ejn.14255. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
2. Sletten TL, et al. Health consequences of circadian disruption. Sleep. 2020;43(1):zsz194. doi: 10.1093/sleep/zsz194. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
3. Chellappa SL, et al. Circadian misalignment increases mood vulnerability in simulated shift work. Sci Rep. 2020;10(1):18614. doi: 10.1038/s41598-020-75245-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
4. Fishbein AB, et al. Nocturnal eczema: review of sleep and circadian rhythms in children with atopic dermatitis and future research directions. J Allergy Clin Immunol. 2015;136(5):1170–1177. doi: 10.1016/j.jaci.2015.08.028. [PubMed] [CrossRef] [Google Scholar]
5. Wang R, et al. Asthma diagnosis: into the fourth dimension. Thorax. 2021;76(6):624–631. doi: 10.1136/thoraxjnl-2020-216421. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
6. Scheer FA, et al. Adverse metabolic and cardiovascular consequences of circadian misalignment. Proc Natl Acad Sci U S A. 2009;106(11):4453–4458. doi: 10.1073/pnas.0808180106. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
7. Abbott SM, et al. Circadian disruption and human health: a bidirectional relationship. Eur J Neurosci. 2020;51(1):567–583. doi: 10.1111/ejn.14298. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
8. Crowley SJ, Eastman CI. Human adolescent phase response curves to bright white light. J Biol Rhythms. 2017;32(4):334–344. doi: 10.1177/0748730417713423. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
9. Luboshitzky R, et al. Actigraphic sleep-wake patterns and urinary 6-sulfatoxymelatonin excretion in patients with Alzheimer’s disease. Chronobiol Int. 2001;18(3):513–524. doi: 10.1081/CBI-100103973. [PubMed] [CrossRef] [Google Scholar]
10. Uberos J, et al. Normalization of the sleep-wake pattern and melatonin and 6-sulphatoxy-melatonin levels after a therapeutic trial with melatonin in children with severe epilepsy. J Pineal Res. 2011;50(2):192–196. [PubMed] [Google Scholar]
11. U.S. Bureau of Labor Statistics. Job Flexibilities and Work Schedules Summary. https://www.bls.gov/news.release/flex2.nr0.htm Updated September 24, 2019. Accessed August 18, 2021.
12. Mendell MJ, et al. Improving the health of workers in indoor environments: priority research needs for a national occupational research agenda. Am J Public Health. 2002;92(9):1430–1440. doi: 10.2105/AJPH.92.9.1430. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
13. Chepesiuk R. Missing the dark: health effects of light pollution. Environ Health Perspect. 2009;117(1):A20–A27. [PMC free article] [PubMed] [Google Scholar]
14. Vincent GK, Velkoff VA. The Next Four Decades: The Older Population in the United States: 2010 to 2050. US Census Bureau; 2010. [Google Scholar]
15. Kolla BP, et al. Increased patient safety-related incidents following the transition into daylight savings time. J Gen Intern Med. 2021;36(1):51–54. doi: 10.1007/s11606-020-06090-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
16. Knutson KL, von Schantz M. Associations between chronotype, morbidity and mortality in the UK Biobank cohort. Chronobiol Int. 2018;35(8):1045–1053. [PMC free article] [PubMed] [Google Scholar]
17. Centers for Disease Control and Prevention. Aircrew Safety & Health: Circaduab Rhythm Disruption (Jet Lag). https://www.cdc.gov/niosh/topics/aircrew/jet lag.html Updated May 9, 2017. Accessed August 18, 2021.
18. Videnovic A, Zee PC. Consequences of circadian disruption on neurologic health. Sleep Med Clin. 2015;10(4):469–480. doi: 10.1016/j.jsmc.2015.08.004. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
19. Lorsung E, et al. Biological timing and neurodevelopmental disorders: a role for circadian dysfunction in autism spectrum disorders. Front Neurosci. 2021;15:642745. [PMC free article] [PubMed] [Google Scholar]
20. Yang Z, et al. Circadian-relevant genes are highly polymorphic in autism spectrum disorder patients. Brain Dev. 2016;38(1):91–99. doi: 10.1016/j.braindev.2015.04.006. [PubMed] [CrossRef] [Google Scholar]
21. Logan RW, McClung CA. Rhythms of life: circadian disruption and brain disorders across the lifespan. Nat Rev Neurosci. 2019;20(1):49–65. doi: 10.1038/s41583-018-0088-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
22. Lacaria M, et al. Circadian abnormalities in mouse models of Smith-Magenis syndrome: evidence for involvement of RAI1. Am J Med Genet A. 2013;161a(7):1561–1568. [PMC free article] [PubMed] [Google Scholar]
23. Smith ACM, et al. Twenty-four-hour motor activity and body temperature patterns suggest altered central circadian timekeeping in Smith-Magenis syndrome, a neurodevelopmental disorder. Am J Med Genet A. 2019;179(2):224–236. doi: 10.1002/ajmg.a.61003. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
24. De Leersnyder H, et al. β1-Adrenergic antagonists improve sleep and behavioural disturbances in a circadian disorder, Smith-Magenis syndrome. J Med Genet. 2001;38(9):586–590. doi: 10.1136/jmg.38.9.586. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
25. Woodford EC, et al. Endogenous melatonin and sleep in individuals with Rare Genetic Neurodevelopmental Disorders (RGND): a systematic review. Sleep Med Rev. 2021;57(rgnd):101433. [PubMed] [Google Scholar]
26. Mundey K, et al. Phase-dependent treatment of delayed sleep phase syndrome with melatonin. Sleep. 2005;28(10):1271–1278. doi: 10.1093/sleep/28.10.1271. [PubMed] [CrossRef] [Google Scholar]
27. Harpsøe NG, et al. Clinical pharmacokinetics of melatonin: a systematic review. Eur J Clin Pharmacol. 2015;71(8):901–909. doi: 10.1007/s00228-015-1873-4. [PubMed] [CrossRef] [Google Scholar]
28. Malow BA, et al. Sleep, growth, and puberty after 2 years of prolonged-release melatonin in children with autism spectrum disorder. J Am Acad Child Adolesc Psychiatry. 2021;60(2):252–261. doi: 10.1016/j.jaac.2019.12.007. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
29. Leng Y, et al. Association of circadian abnormalities in older adults with an increased risk of developing Parkinson disease. JAMA Neurol. 2020;77(10):1270–1278. doi: 10.1001/jamaneurol.2020.1623. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
30. Lim AS, et al. Sleep fragmentation and the risk of incident Alzheimer’s disease and cognitive decline in older persons. Sleep. 2013;36(7):1027–1032. doi: 10.5665/sleep.2802. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
31. Musiek ES, Holtzman DM. Mechanisms linking circadian clocks, sleep, and neurodegeneration. Science. 2016;354(6315):1004–1008. doi: 10.1126/science.aah4968. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
32. Kudo T, et al. Circadian dysfunction in a mouse model of Parkinson’s disease. Exp Neurol. 2011;232(1):66–75. doi: 10.1016/j.expneurol.2011.08.003. [PubMed] [CrossRef] [Google Scholar]
33. Ruan GX, et al. An autonomous circadian clock in the inner mouse retina regulated by dopamine and GABA. PLoS Biol. 2008;6(10):e249. doi: 10.1371/journal.pbio.0060249. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
34. Sakamoto K, et al. Dopamine regulates melanopsin mRNA expression in intrinsically photosensitive retinal ganglion cells. Eur J Neurosci. 2005;22(12):3129–3136. doi: 10.1111/j.1460-9568.2005.04512.x. [PubMed] [CrossRef] [Google Scholar]
35. Fifel K, et al. Alteration of daily and circadian rhythms following dopamine depletion in MPTP treated non-human primates. PLoS One. 2014;9(1):e86240. doi: 10.1371/journal.pone.0086240. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
36. Videnovic A, et al. Circadian melatonin rhythm and excessive daytime sleepiness in Parkinson disease. JAMA Neurol. 2014;71(4):463–469. doi: 10.1001/jamaneurol.2013.6239. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
37. Liu Y, et al. Recent progress in non-motor features of Parkinson’s disease with a focus on circadian rhythm dysregulation. Neurosci Bull. 2021;37(7):1010–1024. doi: 10.1007/s12264-021-00711-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
38. Fifel K, Videnovic A. Circadian and sleep dysfunctions in neurodegenerative disorders-an update. Front Neurosci. 2020;14:627330. [PMC free article] [PubMed] [Google Scholar]
39. Nyholm D, et al. Circadian rhythmicity in levodopa pharmacokinetics in patients with Parkinson disease. Clin Neuropharmacol. 2010;33(4):181–185. doi: 10.1097/WNF.0b013e3181e70f7a. [PubMed] [CrossRef] [Google Scholar]
40. Kim R, Reed MC. A mathematical model of circadian rhythms and dopamine. Theor Biol Med Model. 2021;18(1):8. doi: 10.1186/s12976-021-00139-w. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
41. Slominski AT, et al. How UV light touches the brain and endocrine system through skin, and why. Endocrinology. 2018;159(5):1992–2007. doi: 10.1210/en.2017-03230. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
42. Videnovic A, et al. Timed light therapy for sleep and daytime sleepiness associated with Parkinson disease: a randomized clinical trial. JAMA Neurol. 2017;74(4):411–418. doi: 10.1001/jamaneurol.2016.5192. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
43. Endo T, et al. Bright light improves sleep in patients with Parkinson’s disease: possible role of circadian restoration. Sci Rep. 2020;10(1):7982. doi: 10.1038/s41598-020-64645-6. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
44. Pérez-Lloret S, Cardinali DP. Melatonin as a chronobiotic and cytoprotective agent in Parkinson’s disease. Front Pharmacol. 2021;12:650597. [PMC free article] [PubMed] [Google Scholar]
45. La Morgia C, et al. Retinal ganglion cells and circadian rhythms in Alzheimer’s disease, Parkinson’s disease, and beyond. Front Neurol. 2017;8:162. [PMC free article] [PubMed] [Google Scholar]
46. Gibson EM, et al. Aging in the circadian system: considerations for health, disease prevention and longevity. Exp Gerontol. 2009;44(1-2):51–56. doi: 10.1016/j.exger.2008.05.007. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
47. Hofman MA, Swaab DF. Alterations in circadian rhythmicity of the vasopressin-producing neurons of the human suprachiasmatic nucleus (SCN) with aging. Brain Res. 1994;651(1-2):134–142. doi: 10.1016/0006-8993(94)90689-0. [PubMed] [CrossRef] [Google Scholar]
48. Yamazaki S, et al. Effects of aging on central and peripheral mammalian clocks. Proc Natl Acad Sci U S A. 2002;99(16):10801–10806. doi: 10.1073/pnas.152318499. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
49. Turner PL, Mainster MA. Circadian photoreception: ageing and the eye’s important role in systemic health. Br J Ophthalmol. 2008;92(11):1439–1444. doi: 10.1136/bjo.2008.141747. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
50. Lim AS, et al. Increased fragmentation of rest-activity patterns is associated with a characteristic pattern of cognitive impairment in older individuals. Sleep. 2012;35(5):633–640. doi: 10.5665/sleep.1820. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
51. Wang JL, et al. Suprachiasmatic neuron numbers and rest-activity circadian rhythms in older humans. Ann Neurol. 2015;78(2):317–322. doi: 10.1002/ana.24432. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
52. Chen CY, et al. Effects of aging on circadian patterns of gene expression in the human prefrontal cortex. Proc Natl Acad Sci U S A. 2016;113(1):206–211. doi: 10.1073/pnas.1508249112. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
53. Cermakian N, et al. Circadian clock gene expression in brain regions of Alzheimer’s disease patients and control subjects. J Biol Rhythms. 2011;26(2):160–170. doi: 10.1177/0748730410395732. [PubMed] [CrossRef] [Google Scholar]
54. Park JE, et al. Differential associations of age and Alzheimer’s disease with sleep and rest-activity rhythms across the adult lifespan. Neurobiol Aging. 2021;101:141–149. doi: 10.1016/j.neurobiolaging.2021.01.006. [PubMed] [CrossRef] [Google Scholar]
55. Witting W, et al. Alterations in the circadian rest-activity rhythm in aging and Alzheimer’s disease. Biol Psychiatry. 1990;27(6):563–572. doi: 10.1016/0006-3223(90)90523-5. [PubMed] [CrossRef] [Google Scholar]
56. Loh DH, et al. Misaligned feeding impairs memories. Elife. 2015;4:e09460. [PMC free article] [PubMed] [Google Scholar]
57. Song J, et al. Time-restricted feeding alters isoflurane-induced memory deficits. Transl Neurosci. 2020;11(1):341–355. doi: 10.1515/tnsci-2020-0130. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
58. Monje FJ, et al. Disrupted ultradian activity rhythms and differential expression of several clock genes in interleukin-6-deficient mice. Front Neurol. 2017;8:99. [PMC free article] [PubMed] [Google Scholar]
59. Stevanovic K, et al. Disruption of normal circadian clock function in a mouse model of tauopathy. Exp Neurol. 2017;294:58–67. doi: 10.1016/j.expneurol.2017.04.015. [PubMed] [CrossRef] [Google Scholar]
60. Kim SJ, et al. Positive effect of timed blue-enriched white light on sleep and cognition in patients with mild and moderate Alzheimer’s disease. Sci Rep. 2021;11(1):10174. doi: 10.1038/s41598-021-89521-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
61. Cardoso FDS, et al. Therapeutic potential of photobiomodulation in Alzheimer’s disease: a systematic review. J Lasers Med Sci. 2020;11(suppl 1):S16–S22. doi: 10.34172/jlms.2020.S3. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
62. Cordone S, et al. Sleep-based interventions in Alzheimer’s disease: promising approaches from prevention to treatment along the disease trajectory. Pharmaceuticals (Basel) 2021;14(4):383. doi: 10.3390/ph14040383. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
63. Ancoli-Israel S, et al. Increased light exposure consolidates sleep and strengthens circadian rhythms in severe Alzheimer’s disease patients. Behav Sleep Med. 2003;1(1):22–36. doi: 10.1207/S15402010BSM0101_4. [PubMed] [CrossRef] [Google Scholar]
64. Sumsuzzman DM, et al. Neurocognitive effects of melatonin treatment in healthy adults and individuals with Alzheimer’s disease and insomnia: a systematic review and meta-analysis of randomized controlled trials. Neurosci Biobehav Rev. 2021;127:459–473. doi: 10.1016/j.neubiorev.2021.04.034. [PubMed] [CrossRef] [Google Scholar]
65. McCleery J, et al. Pharmacotherapies for sleep disturbances in dementia. Cochrane Database Syst Rev. 2016;11(11):CD009178. [PMC free article] [PubMed] [Google Scholar]
66. Jones SG, Benca RM. Circadian disruption in psychiatric disorders. Sleep Med Clin. 2015;10(4):481–493. doi: 10.1016/j.jsmc.2015.07.004. [PubMed] [CrossRef] [Google Scholar]
67. Walker WH, et al. Circadian rhythm disruption and mental health. Transl Psychiatry. 2020;10(1):28. doi: 10.1038/s41398-020-0694-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
68. Lewy AJ, et al. The circadian basis of winter depression. Proc Natl Acad Sci U S A. 2006;103(19):7414–7419. doi: 10.1073/pnas.0602425103. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
69. Emens JS, et al. Circadian rhythm in negative affect: implications for mood disorders. Psychiatry Res. 2020;293:113337. [PMC free article] [PubMed] [Google Scholar]
70. Robillard R, et al. Sleep-wake cycle and melatonin rhythms in adolescents and young adults with mood disorders: comparison of unipolar and bipolar phenotypes. Eur Psychiatry. 2013;28(7):412–416. doi: 10.1016/j.eurpsy.2013.04.001. [PubMed] [CrossRef] [Google Scholar]
71. Murray JM, et al. Prevalence of circadian misalignment and its association with depressive symptoms in delayed sleep phase disorder. Sleep. 2017;40(1):zsw002. [PubMed] [Google Scholar]
72. Carpenter JS, et al. Circadian depression: a mood disorder phenotype. Neurosci Biobehav Rev. 2021;126:79–101. doi: 10.1016/j.neubiorev.2021.02.045. [PubMed] [CrossRef] [Google Scholar]
73. Siemann JK, et al. Rhythms, reward, and blues: consequences of circadian photoperiod on affective and reward circuit function. Neuroscience. 2021;457:220–234. doi: 10.1016/j.neuroscience.2020.12.010. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
74. LeGates TA, Kvarta MD. Illuminating a path from light to depression. Nat Neurosci. 2020;23(7):785–787. doi: 10.1038/s41593-020-0659-x. [PubMed] [CrossRef] [Google Scholar]
75. LeGates TA, et al. Aberrant light directly impairs mood and learning through melanopsin-expressing neurons. Nature. 2012;491(7425):594–598. doi: 10.1038/nature11673. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
76. McGlashan EM, et al. Afraid of the dark: light acutely suppresses activity in the human amygdala. PLoS One. 2021;16(6):e0252350. doi: 10.1371/journal.pone.0252350. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
77. Li JZ, et al. Circadian patterns of gene expression in the human brain and disruption in major depressive disorder. Proc Natl Acad Sci U S A. 2013;110(24):9950–9955. doi: 10.1073/pnas.1305814110. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
78. Partonen T. Clock gene variants in mood and anxiety disorders. J Neural Transm (Vienna) 2012;119(10):1133–1145. doi: 10.1007/s00702-012-0810-2. [PubMed] [CrossRef] [Google Scholar]
79. Liberman AR, et al. Modeling strengthens molecular link between circadian polymorphisms and major mood disorders. J Biol Rhythms. 2018;33(3):318–336. doi: 10.1177/0748730418764540. [PubMed] [CrossRef] [Google Scholar]
80. Daghlas I, et al. Genetically proxied diurnal preference, sleep timing, and risk of major depressive disorder. JAMA Psychiatry. 2021;78(8):903–910. doi: 10.1001/jamapsychiatry.2021.0959. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
81. McGlashan EM, et al. The SSRI citalopram increases the sensitivity of the human circadian system to light in an acute dose. Psychopharmacology (Berl) 2018;235(11):3201–3209. doi: 10.1007/s00213-018-5019-0. [PubMed] [CrossRef] [Google Scholar]
82. McCarthy MJ, et al. Chronotype and cellular circadian rhythms predict the clinical response to lithium maintenance treatment in patients with bipolar disorder. Neuropsychopharmacology. 2019;44(3):620–628. doi: 10.1038/s41386-018-0273-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
83. Mishra HK, et al. Circadian rhythms in bipolar disorder patient-derived neurons predict lithium response: preliminary studies. Mol Psychiatry. doi: 10.1038/s41380-021-01048-7. [published online March 5, 2021]. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
84. McCarthy MJ, et al. Genetic and clinical factors predict lithium’s effects on PER2 gene expression rhythms in cells from bipolar disorder patients. Transl Psychiatry. 2013;3(10):e318. doi: 10.1038/tp.2013.90. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
85. Geoffroy PA, et al. Efficacy of light therapy versus antidepressant drugs, and of the combination versus monotherapy, in major depressive episodes: a systematic review and meta-analysis. Sleep Med Rev. 2019;48:101213. [PubMed] [Google Scholar]
86. Tseng PT, et al. Light therapy in the treatment of patients with bipolar depression: a meta-analytic study. Eur Neuropsychopharmacol. 2016;26(6):1037–1047. doi: 10.1016/j.euroneuro.2016.03.001. [PubMed] [CrossRef] [Google Scholar]
87. Hirakawa H, et al. Adjunctive bright light therapy for treating bipolar depression: a systematic review and meta-analysis of randomized controlled trials. Brain Behav. 2020;10(12):e01876. [PMC free article] [PubMed] [Google Scholar]
88. Wang S, et al. Bright light therapy in the treatment of patients with bipolar disorder: a systematic review and meta-analysis. PLoS One. 2020;15(5):e0232798. doi: 10.1371/journal.pone.0232798. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
89. Bedrosian TA, Nelson RJ. Timing of light exposure affects mood and brain circuits. Transl Psychiatry. 2017;7(1):e1017. doi: 10.1038/tp.2016.262. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
90. Maruani J, Geoffroy PA. Bright light as a personalized precision treatment of mood disorders. Front Psychiatry. 2019;10:85. [PMC free article] [PubMed] [Google Scholar]
91. Nussbaumer-Streit B, et al. Light therapy for preventing seasonal affective disorder. Cochrane Database Syst Rev. 2019;3(3):CD011269. [PMC free article] [PubMed] [Google Scholar]
92. Fargason RE, et al. Correcting delayed circadian phase with bright light therapy predicts improvement in ADHD symptoms: A pilot study. J Psychiatr Res. 2017;91:105–110. doi: 10.1016/j.jpsychires.2017.03.004. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
93. van Andel E, et al. Effects of chronotherapy on circadian rhythm and ADHD symptoms in adults with attention-deficit/hyperactivity disorder and delayed sleep phase syndrome: a randomized clinical trial. Chronobiol Int. 2021;38(2):260–269. doi: 10.1080/07420528.2020.1835943. [PubMed] [CrossRef] [Google Scholar]
94. Panda S. Circadian physiology of metabolism. Science. 2016;354(6315):1008–1015. doi: 10.1126/science.aah4967. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
95. Bass J. Circadian topology of metabolism. Nature. 2012;491(7424):348–356. doi: 10.1038/nature11704. [PubMed] [CrossRef] [Google Scholar]
96. Bass J, Takahashi JS. Circadian integration of metabolism and energetics. Science. 2010;330(6009):1349–1354. doi: 10.1126/science.1195027. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
97. Allada R, Bass J. Circadian mechanisms in medicine. N Eng J Med. 2021;384(6):550–561. doi: 10.1056/NEJMra1802337. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
98. Knutson KL, et al. Association between sleep timing, obesity, diabetes: the Hispanic community health study/study of Latinos (HCHS/SOL) Cohort Study. Sleep. 2017;40(4):zsx014. [PMC free article] [PubMed] [Google Scholar]
99. Turek FW, et al. Obesity and metabolic syndrome in circadian Clock mutant mice. Science. 2005;308(5724):1043–1045. doi: 10.1126/science.1108750. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
100. Maury E. Off the clock: from circadian disruption to metabolic disease. Int J Mol Sci. 2019;20(7):1597. doi: 10.3390/ijms20071597. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
101. Parsons MJ, et al. Social jet lag, obesity and metabolic disorder: investigation in a cohort study. Int J Obes (Lond) 2015;39(5):842–848. doi: 10.1038/ijo.2014.201. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
102. Yu JH, et al. Evening chronotype is associated with metabolic disorders and body composition in middle-aged adults. J Clin Endocrinol Metab. 2015;100(4):1494–1502. doi: 10.1210/jc.2014-3754. [PubMed] [CrossRef] [Google Scholar]
103. Merikanto I, et al. Associations of chronotype and sleep with cardiovascular diseases and type 2 diabetes. Chronobiol Int. 2013;30(4):470–477. doi: 10.3109/07420528.2012.741171. [PubMed] [CrossRef] [Google Scholar]
104. Reutrakul S, et al. Chronotype is independently associated with glycemic control in type 2 diabetes. Diabetes Care. 2013;36(9):2523–2529. doi: 10.2337/dc12-2697. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
105. Iwasaki M, et al. Morningness-eveningness questionnaire score correlates with glycated hemoglobin in middle-aged male workers with type 2 diabetes mellitus. J Diabetes Investig. 2013;4(4):376–381. doi: 10.1111/jdi.12047. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
106. Osonoi Y, et al. Morningness-eveningness questionnaire score and metabolic parameters in patients with type 2 diabetes mellitus. Chronobiol Int. 2014;31(9):1017–1023. doi: 10.3109/07420528.2014.943843. [PubMed] [CrossRef] [Google Scholar]
107. Morris CJ, et al. Endogenous circadian system and circadian misalignment impact glucose tolerance via separate mechanisms in humans. Proc Natl Acad Sci U S A. 2015;112(17):E2225–E2234. doi: 10.1073/pnas.1418955112. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
108. Leproult R, et al. Circadian misalignment augments markers of insulin resistance and inflammation, independently of sleep loss. Diabetes. 2014;63(6):1860–1869. doi: 10.2337/db13-1546. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
109. Qian J, et al. Differential effects of the circadian system and circadian misalignment on insulin sensitivity and insulin secretion in humans. Diabetes Obes Metab. 2018;20(10):2481–2485. doi: 10.1111/dom.13391. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
110. Wefers J, et al. Circadian misalignment induces fatty acid metabolism gene profiles and compromises insulin sensitivity in human skeletal muscle. Proc Natl Acad Sci U S A. 2018;115(30):7789–7794. doi: 10.1073/pnas.1722295115. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
111. Facco FL, et al. Objectively measured short sleep duration and later sleep midpoint in pregnancy are associated with a higher risk of gestational diabetes. Am J Obstet Gynecol. 2017;217(4):447.e1–447.e13. doi: 10.1016/j.ajog.2017.05.066. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
112. Cheung IN, et al. Morning and evening blue-enriched light exposure alters metabolic function in normal weight adults. PLoS One. 2016;11(5):e0155601. doi: 10.1371/journal.pone.0155601. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
113. Plano SA, et al. Circadian and metabolic effects of light: implications in weight homeostasis and health. Front Neurol. 2017;8:558. [PMC free article] [PubMed] [Google Scholar]
114. Melanson EL, et al. Daytime bright light exposure, metabolism, and individual differences in wake and sleep energy expenditure during circadian entrainment and misalignment. Neurobiol Sleep Circadian Rhythms. 2018;4:49–56. doi: 10.1016/j.nbscr.2017.12.002. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
115. Baron KG, et al. Role of sleep timing in caloric intake and BMI. Obesity (Silver Spring) 2011;19(7):1374–1381. doi: 10.1038/oby.2011.100. [PubMed] [CrossRef] [Google Scholar]
116. Baron KG, et al. Circadian timing and alignment in healthy adults: associations with BMI, body fat, caloric intake and physical activity. Int J Obes (Lond) 2017;41(2):203–209. doi: 10.1038/ijo.2016.194. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
117. Culnan E, et al. Meal timing relative to DLMO: associations with BMI and body fat. Sleep Health. 2021;7(3):339–344. doi: 10.1016/j.sleh.2021.01.001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
118. Riestra P, et al. Circadian CLOCK gene polymorphisms in relation to sleep patterns and obesity in African Americans: findings from the Jackson heart study. BMC Genet. 2017;18(1):58. doi: 10.1186/s12863-017-0522-6. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
119. Meng Y, et al. Sex modifies the association between the CLOCK variant rs1801260 and BMI in school-age children. PLoS One. 2020;15(8):e0236991. doi: 10.1371/journal.pone.0236991. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
120. Loria-Kohen V, et al. Polymorphism in the CLOCK gene may influence the effect of fat intake reduction on weight loss. Nutrition. 2016;32(4):453–460. doi: 10.1016/j.nut.2015.10.013. [PubMed] [CrossRef] [Google Scholar]
121. Tchio C, et al. Association between MTNR1B polymorphisms and obesity in African American: findings from the Jackson Heart Study. BMC Med Genomics. 2021;14(1):136. doi: 10.1186/s12920-021-00983-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
122. Lane JM, et al. Impact of common diabetes risk variant in MTNR1B on sleep, circadian, and melatonin physiology. Diabetes. 2016;65(6):1741–1751. doi: 10.2337/db15-0999. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
123. Garaulet M, et al. Common type 2 diabetes risk variant in MTNR1B worsens the deleterious effect of melatonin on glucose tolerance in humans. Metabolism. 2015;64(12):1650–1657. doi: 10.1016/j.metabol.2015.08.003. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
124. Lyssenko V, et al. Common variant in MTNR1B associated with increased risk of type 2 diabetes and impaired early insulin secretion. Nat Genet. 2009;41(1):82–88. doi: 10.1038/ng.288. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
125. Prokopenko I, et al. Variants in MTNR1B influence fasting glucose levels. Nat Genet. 2009;41(1):77–81. doi: 10.1038/ng.290. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
126. Lopez-Minguez J, et al. Late dinner impairs glucose tolerance in MTNR1B risk allele carriers: a randomized, cross-over study. Clin Nutr. 2018;37(4):1133–1140. doi: 10.1016/j.clnu.2017.04.003. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
127. McHill AW, et al. Impact of circadian misalignment on energy metabolism during simulated nightshift work. Proc Natl Acad Sci U S A. 2014;111(48):17302–17307. doi: 10.1073/pnas.1412021111. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
128. Qian J, et al. Sex differences in the circadian misalignment effects on energy regulation. Proc Natl Acad Sci U S A. 2019;116(47):23806–23812. doi: 10.1073/pnas.1914003116. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
129. Eriksson AK, et al. Work stress, sense of coherence, and risk of type 2 diabetes in a prospective study of middle-aged Swedish men and women. Diabetes Care. 2013;36(9):2683–2689. doi: 10.2337/dc12-1738. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
130. Pan A, et al. Rotating night shift work and risk of type 2 diabetes: two prospective cohort studies in women. PLoS Med. 2011;8(12):e1001141. doi: 10.1371/journal.pmed.1001141. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
131. Ha M, Park J. Shiftwork and metabolic risk factors of cardiovascular disease. J Occup Health. 2005;47(2):89–95. doi: 10.1539/joh.47.89. [PubMed] [CrossRef] [Google Scholar]
132. Khosravipour M, et al. A systematic review and meta-analysis of the association between shift work and metabolic syndrome: the roles of sleep, gender, and type of shift work. Sleep Med Rev. 2021;57:101427. [PubMed] [Google Scholar]
133. Roenneberg T, et al. Social jet lag and obesity. Curr Biol. 2012;22(10):939–943. doi: 10.1016/j.cub.2012.03.038. [PubMed] [CrossRef] [Google Scholar]
134. Chaix A, et al. Time-restricted feeding is a preventative and therapeutic intervention against diverse nutritional challenges. Cell Metab. 2014;20(6):991–1005. doi: 10.1016/j.cmet.2014.11.001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
135. Sutton EF, et al. Early time-restricted feeding improves insulin sensitivity, blood pressure, and oxidative stress even without weight loss in men with prediabetes. Cell Metab. 2018;27(6):1212–1221. doi: 10.1016/j.cmet.2018.04.010. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
136. Hatori M, et al. Time-restricted feeding without reducing caloric intake prevents metabolic diseases in mice fed a high-fat diet. Cell Metab. 2012;15(6):848–860. doi: 10.1016/j.cmet.2012.04.019. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
137. Rangaraj VR, et al. Association between timing of energy intake and insulin sensitivity: a cross-sectional study. Nutrients. 2020;12(2):503. doi: 10.3390/nu12020503. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
138. McHill AW, et al. Later circadian timing of food intake is associated with increased body fat. Am J Clin Nutr. 2017;106(5):1213–1219. [PMC free article] [PubMed] [Google Scholar]
139. Allaf M, et al. Intermittent fasting for the prevention of cardiovascular disease. Cochrane Database Syst Rev. 2021;1(1):Cd013496. [PMC free article] [PubMed] [Google Scholar]
140. Muller JE, et al. Circadian variation in the frequency of onset of acute myocardial infarction. N Engl J Med. 1985;313(21):1315–1322. doi: 10.1056/NEJM198511213132103. [PubMed] [CrossRef] [Google Scholar]
141. Elliott WJ. Circadian variation in the timing of stroke onset: a meta-analysis. Stroke. 1998;29(5):992–996. doi: 10.1161/01.STR.29.5.992. [PubMed] [CrossRef] [Google Scholar]
142. Twidale N, et al. Morning increase in the time of onset of sustained ventricular tachycardia. Am J Cardiol. 1989;64(18):1204–1206. doi: 10.1016/0002-9149(89)90881-3. [PubMed] [CrossRef] [Google Scholar]
143. Edahiro R, et al. Association of lifestyle-related factors with circadian onset patterns of acute myocardial infarction: a prospective observational study in Japan. BMJ Open. 2014;4(6):e005067. doi: 10.1136/bmjopen-2014-005067. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
144. Kanth R, et al. Circadian patterns of ST elevation myocardial infarction in the new millennium. Clin Med Res. 2013;11(2):66–72. doi: 10.3121/cmr.2013.1120. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
145. Scheer FA, et al. The human endogenous circadian system causes greatest platelet activation during the biological morning independent of behaviors. PLoS One. 2011;6(9):e24549. doi: 10.1371/journal.pone.0024549. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
146. Scheer FA, Shea SA. Human circadian system causes a morning peak in prothrombotic plasminogen activator inhibitor-1 (PAI-1) independent of the sleep/wake cycle. Blood. 2014;123(4):590–593. doi: 10.1182/blood-2013-07-517060. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
147. Pritchett D, Reddy AB. Circadian clocks in the hematologic system. J Biol Rhythms. 2015;30(5):374–388. doi: 10.1177/0748730415592729. [PubMed] [CrossRef] [Google Scholar]
148. Morris CJ, et al. Circadian misalignment increases c-reactive protein and blood pressure in chronic shift workers. J Biol Rhythms. 2017;32(2):154–164. doi: 10.1177/0748730417697537. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
149. Morris CJ, et al. Circadian misalignment increases cardiovascular disease risk factors in humans. Proc Natl Acad Sci U S A. 2016;113(10):E1402–E1411. doi: 10.1073/pnas.1516953113. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
150. Ramsey AM, et al. Environmental circadian disruption increases stroke severity and dysregulates immune response. J Biol Rhythms. 2020;35(4):368–376. doi: 10.1177/0748730420929450. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
151. Corella D, et al. CLOCK gene variation is associated with incidence of type-2 diabetes and cardiovascular diseases in type-2 diabetic subjects: dietary modulation in the PREDIMED randomized trial. Cardiovasc Diabetol. 2016;15:4. [PMC free article] [PubMed] [Google Scholar]
152. Amano H, et al. Interleukin-6 level among shift and night workers in Japan: cross-sectional analysis of the J-HOPE Study. J Atheroscler Thromb. 2018;25(12):1206–1214. doi: 10.5551/jat.42036. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
153. Rizza S, et al. Carotid intimal medial thickness in rotating night shift is related to IL1β/IL6 axis. Nutr Metab Cardiovasc Dis. 2020;30(10):1826–1832. doi: 10.1016/j.numecd.2020.05.028. [PubMed] [CrossRef] [Google Scholar]
154. Rutters F, et al. Is social jet lag associated with an adverse endocrine, behavioral, and cardiovascular risk profile? J Biol Rhythms. 2014;29(5):377–383. doi: 10.1177/0748730414550199. [PubMed] [CrossRef] [Google Scholar]
155. Lucassen EA, et al. Evening chronotype is associated with changes in eating behavior, more sleep apnea, and increased stress hormones in short sleeping obese individuals. PLoS One. 2013;8(3):e56519. doi: 10.1371/journal.pone.0056519. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
156. Lecarpentier Y, et al. Molecular mechanisms underlying the circadian rhythm of blood pressure in normotensive subjects. Curr Hypertens Rep. 2020;22(7):50. doi: 10.1007/s11906-020-01063-z. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
157. de la Sierra A, et al. Nocturnal hypertension or nondipping: which is better associated with the cardiovascular risk profile? Am J Hypertens. 2014;27(5):680–687. doi: 10.1093/ajh/hpt175. [PubMed] [CrossRef] [Google Scholar]
158. Boggia J, et al. Prognostic accuracy of day versus night ambulatory blood pressure: a cohort study. Lancet. 2007;370(9594):1219–1229. doi: 10.1016/S0140-6736(07)61538-4. [PubMed] [CrossRef] [Google Scholar]
159. Lurbe E, et al. Increase in nocturnal blood pressure and progression to microalbuminuria in type 1 diabetes. N Engl J Med. 2002;347(11):797–805. doi: 10.1056/NEJMoa013410. [PubMed] [CrossRef] [Google Scholar]
160. Sűdy ÁR, et al. Association of social jet lag with sleep quality and autonomic cardiac control during sleep in young healthy men. Front Neurosci. 2019;13:950. [PMC free article] [PubMed] [Google Scholar]
161. Fink AM. Measuring the effects of night-shift work on cardiac autonomic modulation: an appraisal of heart rate variability metrics. Int J Occup Med Environ Health. 2020;33(4):409–425. doi: 10.13075/ijomeh.1896.01560. [PubMed] [CrossRef] [Google Scholar]
162. Wang Y, et al. RNAseq shows an all-pervasive day-night rhythm in the transcriptome of the pacemaker of the heart. Sci Rep. 2021;11(1):3565. doi: 10.1038/s41598-021-82202-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
163. Schroder EA, et al. Light phase-restricted feeding slows basal heart rate to exaggerate the type-3 long QT syndrome phenotype in mice. Am J Physiol Heart Circ Physiol. 2014;307(12):H1777–H1785. doi: 10.1152/ajpheart.00341.2014. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
164. West AC, et al. Misalignment with the external light environment drives metabolic and cardiac dysfunction. Nat Commun. 2017;8(1):417. doi: 10.1038/s41467-017-00462-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
165. Eckle T, et al. Adora2b-elicited Per2 stabilization promotes a HIF-dependent metabolic switch crucial for myocardial adaptation to ischemia. Nat Med. 2012;18(5):774–782. doi: 10.1038/nm.2728. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
166. Oyama Y, et al. The circadian PER2 enhancer nobiletin reverses the deleterious effects of midazolam in myocardial ischemia and reperfusion injury. Curr Pharm Des. 2018;24(28):3376–3383. doi: 10.2174/1381612824666180924102530. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
167. Bartman CM, et al. Intense light-elicited upregulation of miR-21 facilitates glycolysis and cardioprotection through Per2-dependent mechanisms. PLoS One. 2017;12(4):e0176243. doi: 10.1371/journal.pone.0176243. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
168. Güler AD, et al. Melanopsin cells are the principal conduits for rod-cone input to non-image-forming vision. Nature. 2008;453(7191):102–105. doi: 10.1038/nature06829. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
169. Bendová Z, Sumová A. Photoperiodic regulation of PER1 and PER2 protein expression in rat peripheral tissues. Physiol Res. 2006;55(6):623–632. [PubMed] [Google Scholar]
170. Oyama Y, et al. Intense light-mediated circadian cardioprotection via transcriptional reprogramming of the endothelium. Cell Rep. 2019;28(6):1471–1484. doi: 10.1016/j.celrep.2019.07.020. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
171. Oyama Y, et al. Intense light as anticoagulant therapy in humans. PLoS One. 2020;15(12):e0244792. doi: 10.1371/journal.pone.0244792. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
172. Brito LC, et al. Morning versus evening aerobic training effects on blood pressure in treated hypertension. Med Sci Sports Exerc. 2019;51(4):653–662. doi: 10.1249/MSS.0000000000001852. [PubMed] [CrossRef] [Google Scholar]
173. Hermida RC, et al. Bedtime hypertension treatment improves cardiovascular risk reduction: the Hygia Chronotherapy Trial. Eur Heart J. 2020;41(48):4565–4576. doi: 10.1093/eurheartj/ehz754. [PubMed] [CrossRef] [Google Scholar]
174. Kreutz R, et al. Disregard the reported data from the HYGIA project: blood pressure medication not to be routinely dosed at bedtime. J Hypertens. 2020;38(11):2144–2145. doi: 10.1097/HJH.0000000000002671. [PubMed] [CrossRef] [Google Scholar]
175. Xie Z, et al. Chronotherapy for morning blood pressure surge in hypertensive patients: a systematic review and meta-analysis. BMC Cardiovasc Disord. 2021;21(1):274. doi: 10.1186/s12872-021-02081-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
176. Bowles NP, et al. Chronotherapy for hypertension. Curr Hypetertens Rep. 2018;20(11):97. doi: 10.1007/s11906-018-0897-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
177. Serinel Y, et al. Chronotherapy for hypertension in obstructive sleep apnoea (CHOSA): a randomised, double-blind, placebo-controlled crossover trial. Thorax. 2017;72(6):550–558. doi: 10.1136/thoraxjnl-2016-209504. [PubMed] [CrossRef] [Google Scholar]
178. Bobkowski W, et al. Measures of heart rate variability in 24-h ECGs depend on age but not gender of healthy children. Front Physiol. 2017;8:311. [PMC free article] [PubMed] [Google Scholar]
179. Stephenson EA, et al. Circadian and seasonal variation of malignant arrhythmias in a pediatric and congenital heart disease population. J Cardiovasc Electrophysiol. 2002;13(10):1009–1014. doi: 10.1046/j.1540-8167.2002.01009.x. [PubMed] [CrossRef] [Google Scholar]
180. Kardelen F, et al. Heart rate variability and circadian variations in type 1 diabetes mellitus. Pediatr Diabetes. 2006;7(1):45–50. doi: 10.1111/j.1399-543X.2006.00141.x. [PubMed] [CrossRef] [Google Scholar]
181. Wolfenstetter A, et al. Altered cardiovascular rhythmicity in children born small for gestational age. Hypertension. 2012;60(3):865–870. doi: 10.1161/HYPERTENSIONAHA.112.196949. [PubMed] [CrossRef] [Google Scholar]
182. Qian J, et al. Blunted rest-activity rhythms link to higher body mass index and inflammatory markers in children. Sleep. 2021;44(5):zsaa256. doi: 10.1093/sleep/zsaa256. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
183. Macumber IR, et al. The association of pediatric obesity with nocturnal non-dipping on 24-hour ambulatory blood pressure monitoring. Am J Hypertens. 2016;29(5):647–652. doi: 10.1093/ajh/hpv147. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
184. Chang JC, et al. Nocturnal blood pressure dipping as a marker of endothelial function and subclinical atherosclerosis in pediatric-onset systemic lupus erythematosus. Arthritis Res Ther. 2020;22(1):129. doi: 10.1186/s13075-020-02224-w. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
185. Dionne JM, et al. Blood pressure abnormalities in children with chronic kidney disease. Blood Press Monit. 2008;13(4):205–209. doi: 10.1097/MBP.0b013e3283052fd0. [PubMed] [CrossRef] [Google Scholar]
186. Crowley SJ, et al. Estimating dim light melatonin onset (DLMO) phase in adolescents using summer or school-year sleep/wake schedules. Sleep. 2006;29(12):1632–1641. doi: 10.1093/sleep/29.12.1632. [PubMed] [CrossRef] [Google Scholar]
187. Crowley SJ, et al. A longitudinal assessment of sleep timing, circadian phase, and phase angle of entrainment across human adolescence. PLoS One. 2014;9(11):e112199. doi: 10.1371/journal.pone.0112199. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
188. Martínez-Lozano N, et al. Evening types have social jet lag and metabolic alterations in school-age children. Sci Rep. 2020;10(1):16747. doi: 10.1038/s41598-020-73297-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
189. Mitchell JA, et al. Targeting sleep duration and timing for prevention of adolescent obesity. JAMA Pediatr. 2019;173(11):1018–1020. doi: 10.1001/jamapediatrics.2019.3080. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
190. Cespedes Feliciano EM, et al. Chronotype, social jet lag, and cardiometabolic risk factors in early adolescence. JAMA Pediatr. 2019;173(11):1049–1057. doi: 10.1001/jamapediatrics.2019.3089. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
191. Touitou Y, et al. Disruption of adolescents’ circadian clock: the vicious circle of media use, exposure to light at night, sleep loss and risk behaviors. J Physiol Paris. 2016;110(4 pt b):467–479. [PubMed] [Google Scholar]
192. Mathew GM, et al. Social jet lag, eating behaviours and BMI among adolescents in the USA. Br J Nutr. 2020;124(9):979–987. doi: 10.1017/S0007114520001804. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
193. Labrecque N, Cermakian N. Circadian clocks in the immune system. J Biol Rhythms. 2015;30(4):277–290. doi: 10.1177/0748730415577723. [PubMed] [CrossRef] [Google Scholar]
194. Cuesta M, et al. Simulated night shift disrupts circadian rhythms of immune functions in humans. J Immunol. 2016;196(6):2466–2475. doi: 10.4049/jimmunol.1502422. [PubMed] [CrossRef] [Google Scholar]
195. Fortier EE, et al. Circadian variation of the response of T cells to antigen. J Immunol. 2011;187(12):6291–6300. doi: 10.4049/jimmunol.1004030. [PubMed] [CrossRef] [Google Scholar]
196. Nguyen KD, et al. Circadian gene Bmal1 regulates diurnal oscillations of Ly6C(hi) inflammatory monocytes. Science. 2013;341(6153):1483–1488. doi: 10.1126/science.1240636. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
197. Druzd D, et al. Lymphocyte circadian clocks control lymph node trafficking and adaptive immune responses. Immunity. 2017;46(1):120–132. doi: 10.1016/j.immuni.2016.12.011. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
198. Scheiermann C, et al. Clocking in to immunity. Nat Rev Immunol. 2018;18(7):423–437. doi: 10.1038/s41577-018-0008-4. [PubMed] [CrossRef] [Google Scholar]
199. Man K, et al. Immunity around the clock. Science. 2016;354(6315):999–1003. doi: 10.1126/science.aah4966. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
200. Yu X, et al. TH17 cell differentiation is regulated by the circadian clock. Science. 2013;342(6159):727–730. doi: 10.1126/science.1243884. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
201. Spiegel K, et al. Effect of sleep deprivation on response to immunization. JAMA. 2002;288(12):1471–1472. [PubMed] [Google Scholar]
202. Greenberg EN, et al. Circadian control of interferon-sensitive gene expression in murine skin. Proc Natl Acad Sci U S A. 2020;117(11):5761–5771. doi: 10.1073/pnas.1915773117. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
203. Castanon-Cervantes O, et al. Dysregulation of inflammatory responses by chronic circadian disruption. J Immunol. 2010;185(10):5796–5805. doi: 10.4049/jimmunol.1001026. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
204. Durrington HJ, et al. The circadian clock and asthma. Thorax. 2014;69(1):90–92. doi: 10.1136/thoraxjnl-2013-203482. [PubMed] [CrossRef] [Google Scholar]
205. Nakao A. Circadian regulation of the biology of allergic disease: clock disruption can promote allergy. Front Immunol. 2020;11:1237. [PMC free article] [PubMed] [Google Scholar]
206. Silva FRD, et al. Does the compromised sleep and circadian disruption of night and shiftworkers make them highly vulnerable to 2019 coronavirus disease (COVID-19)? Chronobiol Int. 2020;37(5):607–617. doi: 10.1080/07420528.2020.1756841. [PubMed] [CrossRef] [Google Scholar]
207. Goren A, et al. Clock genes may drive seasonal variation in SARS-CoV-2 infectivity: are we due for a second wave of COVID-19 in the fall? J Biol Regul Homeost Agents. 2020;34(4):1455–1457. [PubMed] [Google Scholar]
208. Fatima Y, et al. Shift work is associated with increased risk of COVID-19: findings from the UK Biobank cohort. J Sleep Res. doi: 10.1111/jsr.13326. [published online March 8, 2021]. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
209. Edgar RS, et al. Cell autonomous regulation of herpes and influenza virus infection by the circadian clock. Proc Natl Acad Sci U S A. 2016;113(36):10085–10090. doi: 10.1073/pnas.1601895113. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
210. Zhuang X, et al. Circadian control of hepatitis B virus replication. Nat Commun. 2021;12(1):1658. doi: 10.1038/s41467-021-21821-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
211. Vitale JA, et al. Is disruption of sleep quality a consequence of severe Covid-19 infection? A case-series examination. Chronobiol Int. 2020;37(7):1110–1114. doi: 10.1080/07420528.2020.1775241. [PubMed] [CrossRef] [Google Scholar]
212. Haspel J, et al. A timely call to arms: COVID-19, the circadian clock, and critical care. J Biol Rhythms. 2021;36(1):55–70. doi: 10.1177/0748730421992587. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
213. Ray S, Reddy AB. COVID-19 management in light of the circadian clock. Nat Rev Mol Cell Biol. 2020;21(9):494–495. doi: 10.1038/s41580-020-0275-3. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
214. Sengupta S, et al. Accounting for time: circadian rhythms in the time of COVID-19. J Biol Rhythms. 2021;36(1):4–8. doi: 10.1177/0748730420953335. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
215. De Giorgi A, et al. Morning vs. evening administration of antiviral therapy in COVID-19 patients. A preliminary retrospective study in Ferrara, Italy. Eur Rev Med Pharmacol Sci. 2020;24(15):8219–8225. [PubMed] [Google Scholar]
216. Matsunaga N, et al. 24-Hour rhythm of aquaporin-3 function in the epidermis is regulated by molecular clocks. J Invest Dermatol. 2014;134(6):1636–1644. doi: 10.1038/jid.2014.13. [PubMed] [CrossRef] [Google Scholar]
217. Kyoko OO, et al. Expressions of tight junction proteins Occludin and Claudin-1 are under the circadian control in the mouse large intestine: implications in intestinal permeability and susceptibility to colitis. PLoS One. 2014;9(5):e98016. doi: 10.1371/journal.pone.0098016. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
218. Gibbs J, et al. An epithelial circadian clock controls pulmonary inflammation and glucocorticoid action. Nat Med. 2014;20(8):919–926. doi: 10.1038/nm.3599. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
219. Ehlers A, et al. BMAL1 links the circadian clock to viral airway pathology and asthma phenotypes. Mucosal Immunol. 2018;11(1):97–111. doi: 10.1038/mi.2017.24. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
220. Durrington HJ, et al. Circadian asthma airway responses are gated by REV-ERBα Eur Respir J. 2020;56(6):1902407. [PMC free article] [PubMed] [Google Scholar]
221. Maidstone RJ, et al. Night shift work is associated with an increased risk of asthma. Thorax. 2021;76(1):53–60. doi: 10.1136/thoraxjnl-2020-215218. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
222. Langwinski W, et al. Association of circadian clock TIMELESS variants and expression with asthma risk in children. Clin Respir J. 2020;14(12):1191–1200. doi: 10.1111/crj.13260. [PubMed] [CrossRef] [Google Scholar]
223. Manella G, et al. Hypoxia induces a time- and tissue-specific response that elicits intertissue circadian clock misalignment. Proc Natl Acad Sci U S A. 2020;117(1):779–786. doi: 10.1073/pnas.1914112117. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
224. Singulair. Product monograph. Merck Canada Inc.; 2020. Accessed August 18, 2021. https://www.merck.ca/static/pdf/SINGULAIR-PM_E.pdf.
225. Bavishi AA, et al. Diurnal variations in subcutaneous allergen immunotherapy reactions. Ann Allergy Asthma Immunol. 2017;118(1):103–107. doi: 10.1016/j.anai.2016.10.007. [PubMed] [CrossRef] [Google Scholar]
226. Nakao A, et al. The circadian clock functions as a potent regulator of allergic reaction. Allergy. 2015;70(5):467–473. doi: 10.1111/all.12596. [PubMed] [CrossRef] [Google Scholar]
227. Padem N, Fishbein A, eds. Allergy and Sleep. Springer; 2019. [Google Scholar]
228. Nakamura Y, et al. Circadian regulation of allergic reactions by the mast cell clock in mice. J Allergy Clin Immunol. 2014;133(2):568–575. doi: 10.1016/j.jaci.2013.07.040. [PubMed] [CrossRef] [Google Scholar]
229. Nakamura Y, et al. Circadian clock gene Period2 regulates a time-of-day-dependent variation in cutaneous anaphylactic reaction. J Allergy Clin Immunol. 2011;127(4):1038–1045. doi: 10.1016/j.jaci.2011.02.006. [PubMed] [CrossRef] [Google Scholar]
230. Nakamura Y, et al. Time-restricted feeding in rest phase alters IgE/mast cell-mediated allergic reaction in mice. Allergol Int. 2020;69(2):296–299. doi: 10.1016/j.alit.2019.09.004. [PubMed] [CrossRef] [Google Scholar]
231. Bousquet J, et al. Allergic rhinitis and its impact on asthma. J Allergy Clin Immunol. 2001;108(5 suppl):S147–S334. [PubMed] [Google Scholar]
232. Cloutier MM, et al. 2020 focused updates to the Asthma Management Guidelines: a report from the National Asthma Education and Prevention Program Coordinating Committee Expert Panel Working Group. J Allergy Clin Immunol. 2020;146(6):1217–1270. doi: 10.1016/j.jaci.2020.10.003. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
233. National Asthma Education Prevention Program Expert Panel Report 3 (EPR-3): Guidelines for the Diagnosis and Management of Asthma—Summary Report 2007. J Allergy Clin Immunol. 2007;120(5 suppl):S94–S138. [PubMed] [Google Scholar]
234. Kraft M, et al. Blood and bronchoalveolar lavage endothelin-1 levels in nocturnal asthma. Am J Respir Crit Care Med. 1994;149(4 pt 1):946–952. [PubMed] [Google Scholar]
235. Barnes P, et al. Nocturnal asthma and changes in circulating epinephrine, histamine, and cortisol. N Engl J Med. 1980;303(5):263–267. doi: 10.1056/NEJM198007313030506. [PubMed] [CrossRef] [Google Scholar]
236. Fishbein AB, et al. Nocturnal movements in children with atopic dermatitis have a timing pattern: a case-control study. J Am Acad Dermatol. 2021;85(2):474–476. doi: 10.1016/j.jaad.2018.04.020. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
237. Nakamura Y, et al. Inhibition of IgE-mediated allergic reactions by pharmacologically targeting the circadian clock. J Allergy Clin Immunol. 2016;137(4):1226–1235. doi: 10.1016/j.jaci.2015.08.052. [PubMed] [CrossRef] [Google Scholar]
238. Cunningham PS, et al. The circadian clock protein REVERBα inhibits pulmonary fibrosis development. Proc Natl Acad Sci U S A. 2020;117(2):1139–1147. doi: 10.1073/pnas.1912109117. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
239. Zhang R, et al. A circadian gene expression atlas in mammals: implications for biology and medicine. Proc Natl Acad Sci U S A. 2014;111(45):16219–16224. doi: 10.1073/pnas.1408886111. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
240. Ruben MD, et al. Dosing time matters. Science. 2019;365(6453):547–549. doi: 10.1126/science.aax7621. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Artykuły z Journal of Clinical Investigation są tutaj dostarczane dzięki uprzejmości American Society for Clinical Investigation
